1.概念:平衡常数指一定温度下反应达平衡时生成物浓度幂之积与反应物浓度幂之积的比值。
2.注意:①K值与温度有关,温度变化K值变化。②K表达式中浓度应用平衡时浓度。③幂底数是平衡时浓度,幂指数是物质方程式中对应计量数。④K表达式中遇固体、纯液体浓度视为常数,用数字1表示其浓度值。⑤平衡移动,k值不一定变化。浓度、压强引起的平衡移动K值不变。
3.应用:
①比较反应进行程度,K值越大,反应进行程度越大,转化率越大。
②温度变化K值变化,用于判断反应吸、放热。
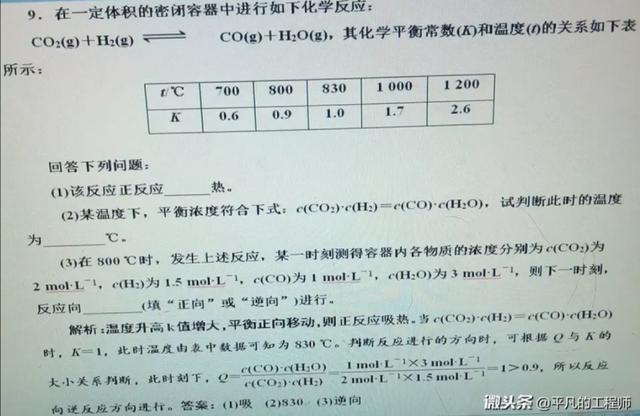
若温度升高K值增大,则正反应吸热。
若温度升高K值减小,则正反应放热。
若温度降低K值增大,则正反应放热。
若温度降低K值减小,则正反应吸热。
③一定温度下,任意时刻生成物浓度幂之积与反应物浓度幂之积比值(Qc)与K值比较判断反应进行的方向。
若Qc=k 反应处于平衡状态
若Qc>K 反应逆向进行
若Qc<K 反应正向进行。
④转化率、平衡浓度等的计算(常借助"三段式")

 加载中,请稍侯......
加载中,请稍侯......
精彩评论