酸和碱基础知识必背清单
1.酸碱指示剂:能跟酸或碱的溶液起作用而显示不同颜色的物质叫做酸碱指示剂。
2.常见的酸碱指示剂有紫色石蕊溶液和无色酚酞溶液。某些植物的花瓣或果实(如牵牛花、月季花、紫卷心菜等)也可用作酸碱指示剂。
3.紫色石蕊溶液遇酸溶液(含H+的溶液)变红,遇碱溶液(含OH-的溶液)变蓝,在中性溶液中呈紫色。
无色酚酞溶液遇酸溶液不变色,在中性溶液中不变色,遇碱溶液变红。
4.酸:物质溶于水时,形成的阳离子全部是H+的化合物。
5.常见的酸
盐酸 | 硫酸 | |
化学式 | HCl | H2SO4 |
状态 | 无色液体、具有酸味、刺激性气味 | (浓硫酸)无色粘稠的油状液体 (稀硫酸)无色液体 |
特点 | 浓盐酸具有强挥发性 | ① 浓硫酸具有吸水性(物理性质) ② 浓硫酸具有强腐蚀性(化学性质) ③ 浓硫酸溶于水时会放出大量热 |
用途 | 重要化工产品,用于金属表面除锈、制药 人体胃液中含有盐酸,可以帮助消化 | 重要化工原料,用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等 在实验室中常用浓硫酸作干燥剂 |
敞口放置的变化 | 质量减小,溶质质量分数减小(挥发性) | 质量变大,溶质质量分数减小(吸水性) |
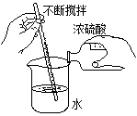
注意事项 | ① 工业生产的盐酸偏黄,是因为含有Fe3 +,可用蒸馏法提纯。 ② 打开浓盐酸的瓶塞,会有白雾出现,是因为:挥发的氯化氢气体极易溶于水,挥发时溶解的氯化氢与水蒸气形成了盐酸的小液滴。 | ① 浓硫酸的稀释:把浓硫酸沿器壁慢慢注入,并不断用玻璃棒搅拌(目的:加快溶解、散热)。 ② 如果把水倒进浓硫酸里,由于水的密度小,浮在硫酸上面,硫酸溶解时放出的热不易散失,使水暴沸,使硫酸液滴向四周飞溅,导致危险。 |
6.浓硫酸能将纸张、木材、布料、皮肤中的氢、氧元素按水的组成比脱去,这种作用通常叫做脱水作用。
7. 浓硫酸的稀释操作如右图:
8.酸的化学性质
酸有相同的化学性质是因为酸在水中都能电离出H+,有不同的化学性质是因为能电离出的酸根离子不同。
1. 酸溶液能使酸碱指示剂变色:使紫色石蕊溶液变红。
2. 酸+活泼金属 → 盐+氢气(置换反应)
a) 这里不包括浓硫酸和硝酸。
b) 示例:Fe+2HCl=FeCl2+H2↑ 和 Fe+H2SO4=FeSO4+H2↑
3. 酸+金属氧化物 → 盐+水(复分解反应)
a) 金属氧化物可以是活泼金属的氧化物和不活泼金属的氧化物。因为生成物有水,符合复分解反应的发生条件,所以反应一定发生。
b) 示例1:Fe2O3+6HCl=2FeCl3+3H2O 和 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O示例2:CuO+2HCl=CuCl2+H2O 和 CuO+H2SO4=CuSO4+H2O
4. 酸+碱 → 盐+水(复分解反应、中和反应)
5. 酸+盐 → 新酸+新盐(复分解反应)
a) 反应发生的条件:① 新酸是碳酸; ② 如果新酸不是碳酸,新盐必须是沉淀。
b) 碳酸盐都能与酸反应:CaCO3+2HCl=CaCl2+H2O+CO2↑
c) 除硫酸钡以外的钡盐都能与硫酸反应:BaCl2+H2SO4=BaSO4↓+ 2HCl(注意:HCl是稀盐酸,不写↑)
d) 硝酸银能与盐酸反应:AgNO3+HCl=HNO3+AgCl↓
9.碱:物质溶于水时,形成的阳离子全部是OH-的化合物。
10.常见的碱
氢氧化钠(烧碱、火碱、苛性钠) | 氢氧化钙(消石灰、熟石灰) | |
化学式 | NaOH | Ca(OH)2 |
工业制法 | Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ | CaCO3 CaO+CO2↑,CaO+H2O=Ca(OH)2 |
状态 | 白色块状固体 | 白色粉末状固体 |
腐蚀性 | 强腐蚀性 | 较强腐蚀性 |
特点 | 极易溶于水,溶于水时放出大量的热。 氢氧化钠固体易吸水而潮解。 | 微溶于水,溶于水时放热不明显。 |
用途 | 用于肥皂、石油、造纸、纺织和印染等行业(除玻璃方面外,用途与纯碱类似)。 氢氧化钠能与油脂反应,所以可以除油污。 | 漂白粉、建筑材料、改良酸性土壤和河流、配制波尔多液 在实验室中可以证明二氧化碳。 |
11.氢氧化钠必须密封有两个原因:①潮解(物理变化);②变质:能与空气中的二氧化碳反应:2NaOH+CO2=Na2CO3+H2O。(化学变化)
12.碱的化学性质
碱有相同的化学性质是因为不同的碱溶液中都含有相同的OH-。
1. 碱溶液能使指示剂变色:使紫色石蕊溶液变蓝,使无色酚酞溶液变红。
2. 碱+非金属氧化物 → 盐+水(复分解反应)
a) 反应发生的条件:非金属氧化物是二氧化碳、二氧化硫、三氧化硫。
b) 根据条件我们必须掌握的三个化学方程式是:
2NaOH+CO2=Na2CO3+H2O(用氢氧化钠溶液吸收二氧化碳)
2NaOH+SO2=Na2SO3+H2O
Ca(OH)2+CO2=CaCO3↓+ H2O(检验二氧化碳;石灰墙“出汗”)
3. 碱+酸 → 盐+水(复分解反应、中和反应)
4. 碱+盐 → 新碱+新盐(复分解反应)
a) 反应发生的条件:① 反应物能溶于水; ② 满足复分解反应条件。
b) 新碱是沉淀:
蓝色沉淀 – 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
红褐色沉淀 – 3NaOH+FeCl3=3NaCl+Fe(OH)3↓
白色沉淀 – 2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
c) 新盐是沉淀:
Ba(OH)2+Na2SO4=BaSO4↓+ 2NaOH
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
d) 蓝白沉淀:Ba(OH)2+CuSO4=BaSO4↓+ Cu(OH)2↓
e) 红白沉淀:3Ba(OH)2+Fe2(SO4)3=3BaSO4↓+ 2Fe(OH)3↓
f) 波尔多液(注:波尔多液不是溶液):Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓
13.中和反应:酸和碱作用生成盐和水的反应。必须强调两点:1.酸和碱反应;2.生成盐和水
14.l中和反应是放热的反应,不属于四大基本反应类型。
15.l中和反应的应用
na.熟石灰改良酸性土壤(在缺少熟石灰的情况下,用生石灰也可以)。
b.熟石灰改良酸性河流(处理硫酸厂的污水:H2SO4+Ca(OH)2=CaSO4+2H2O。
nc.用含氢氧化铝或氢氧化镁的药物中和过多的胃酸:
d.被蚊虫叮咬时涂含氨水(或者是牙膏、肥皂水)的药物。
16.溶液的酸碱度用pH表示。pH的范围通常在0~14之间,酸性溶液的pH < 7,中性溶液的pH = 7,碱性溶液的pH > 7.
17.H+的浓度越大,溶液的酸性越强,pH越小;OH-的浓度越大,溶液的碱性越强,pH越大。
18.加水稀释只能使酸性或碱性溶液的pH无限靠近7,但不能改变溶液的酸碱性。
19.pH试纸的使用步骤:在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒将待测液体滴到pH试纸上,将pH试纸显示的颜色与标准比色卡比较。
20.使用pH试纸时的注意事项:
(1)不能把pH试纸浸在待测液体中。
(2)pH试纸不能用水润湿。
(3)pH试纸测出的pH值是整数。
21.雨水的pH(因溶解有CO2,正常雨水的pH约为5.6,酸雨的pH小于5.6)
22.氢氧化钠和氢氧化钙变质
A.氢氧化钠变质:氢氧化钠变质是因为与空气中的二氧化碳反应生成碳酸钠。
证明方法:
a) 取样,加过量的稀盐酸,如果有气泡产生,说明氢氧化钠已经变质:
NaOH+HCl=NaCl+H2O 和 Na2CO3+2HCl=2NaCl+H2O+CO2↑
b) 取样,加氢氧化钙溶液,如果有白色沉淀产生,说明氢氧化钠已经变质:
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
c) 取样,加氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明NaOH已经变质:
Na2CO3+CaCl2=2NaCl+CaCO3↓ 或 Na2CO3+Ca(NO3)2=2NaNO3+CaCO3↓
B.氢氧化钙变质
氢氧化钙变质是因为与空气中的二氧化碳反应生成碳酸钙。
证明方法:取样,加入过量的稀盐酸,如果有气泡产生,说明氢氧化钙已经变质:
Ca(OH)2+2HCl=CaCl2+2H2O
CaCO3+2HCl=CaCl2+H2O+CO2↑
1. 氢氧化钠固体和氢氧化钙固体变质时,固体质量都会增加。
23.氢氧化钠和氢氧化钙部分变质
A.氢氧化钠部分变质的证明方法:
① 取样,(如果是固体,就需要加适量水,使固体完全溶解),加过量的氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明碳酸钠存在:
Na2CO3+CaCl2=2NaCl+CaCO3↓ 或 Na2CO3+Ca(NO3)2=2NaNO3+CaCO3↓
② 过滤,向滤液中滴加酚酞溶液,如果滤液变红,说明氢氧化钠存在,氢氧化钠部分变质。
B.氢氧化钙固体部分变质的证明方法:
① 取样,加适量水使固体完全溶解,加入过量的稀盐酸,如果有气泡产生,说明碳酸钙存在:
CaCO3+2HCl=CaCl2+H2O+CO2↑
② 另取少量固体,加氯化铵(或硫酸铵)研磨,如果闻到刺激性氨味,说明氢氧化钙存在,氢氧化钙部分变质:Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O 或 Ca(OH)2+(NH4)2SO4=CaSO4+2NH3↑+2H2O
 加载中,请稍侯......
加载中,请稍侯......
精彩评论