第十单元 酸和碱
课时1 常见的酸和碱
命题点1 常见酸的性质及用途(6年2考)
1. (2014江西10题2分)向一定量稀盐酸中分别加入足量的以下物质,下列图像能正确反映对应变化关系的是( )

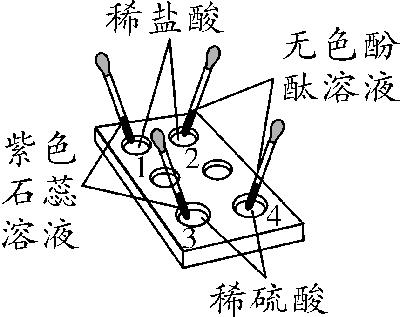
2. [2011江西19(3)题2分]化学小实验是我们进一步认识物质及其变化的重要方式。
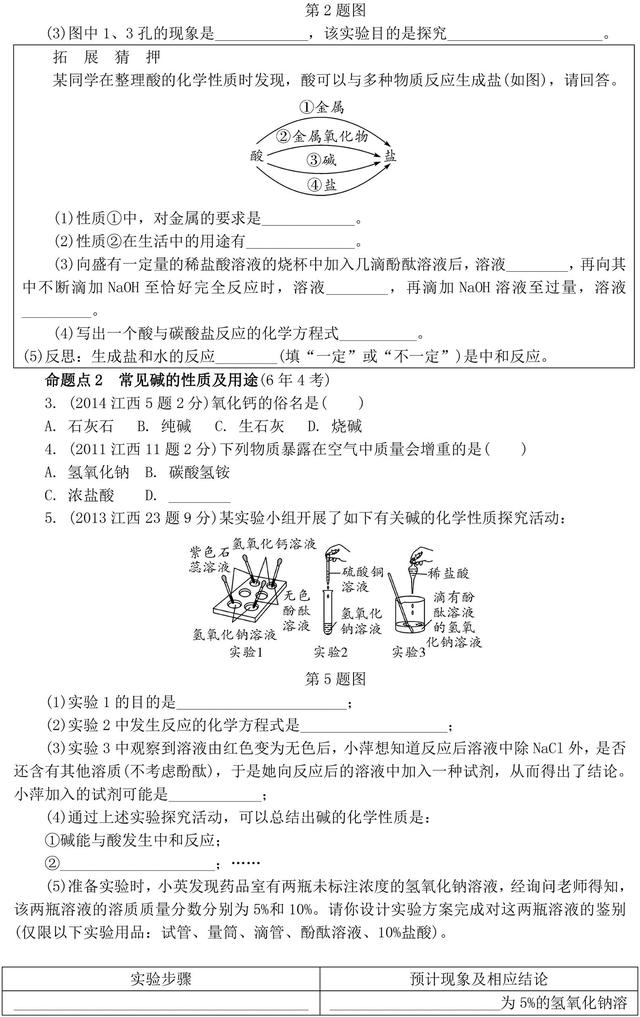

【解析】(1)实验1用了两种碱和两种指示剂,所以实验的目的是探究碱与指示剂的作用。(2)实验2将硫酸铜溶液与氢氧化钠溶液混合,两者反应生成硫酸钠和氢氧化铜沉淀。(3)实验3酚酞遇碱性溶液变红,酚酞在酸性和中性溶液中不变色,所以实验3之后得到的溶液为无色,溶液可能显中性,也可能显酸性,根据氢氧化钠和盐酸的反应可知,溶液中的溶质一定有氯化钠,可能含有HCl,要证明溶液中还含有盐酸,可利用酸的化学性质:与指示剂反应、与活泼金属反应、与金属氧化物反应、与碳酸盐反应、与碱反应等设计实验,为确保反应现象明显,可选择的试剂有紫色石蕊溶液、镁、锌、氧化铁、氧化铜、碳酸钠、碳酸钙等。(4)根据以上三个实验,说明碱能与指示剂反应,碱能与某些盐反应,碱能与酸发生中和反应;用指定的药品和仪器鉴别浓度不同的两种氢氧化钠溶液是难点,难点在于只想到两种溶液的共性——碱性,不能从量的角度认识化学变化,即消耗等量的盐酸需两种溶液的体积不同设计实验。本题设计实验的思路是比较中和相同体积的不同溶质质量分数的NaOH溶液所需盐酸的体积,浓度小的氢氧化钠溶液所需体积小,浓度大的氢氧化钠溶液所需体积大;比较中和等体积的两种碱溶液所需盐酸的体积,浓的氢氧化钠溶液完全中和消耗盐酸的体积大,稀的氢氧化钠溶液完全中和所需盐酸的体积小;此外,由于不同浓度的氢氧化钠溶液的碱性强弱不同,在等体积的两种溶液中滴加等量的指示剂,应该显示不同的颜色,故也可直接取样,滴加酚酞,通过比较溶液的颜色进行判断。
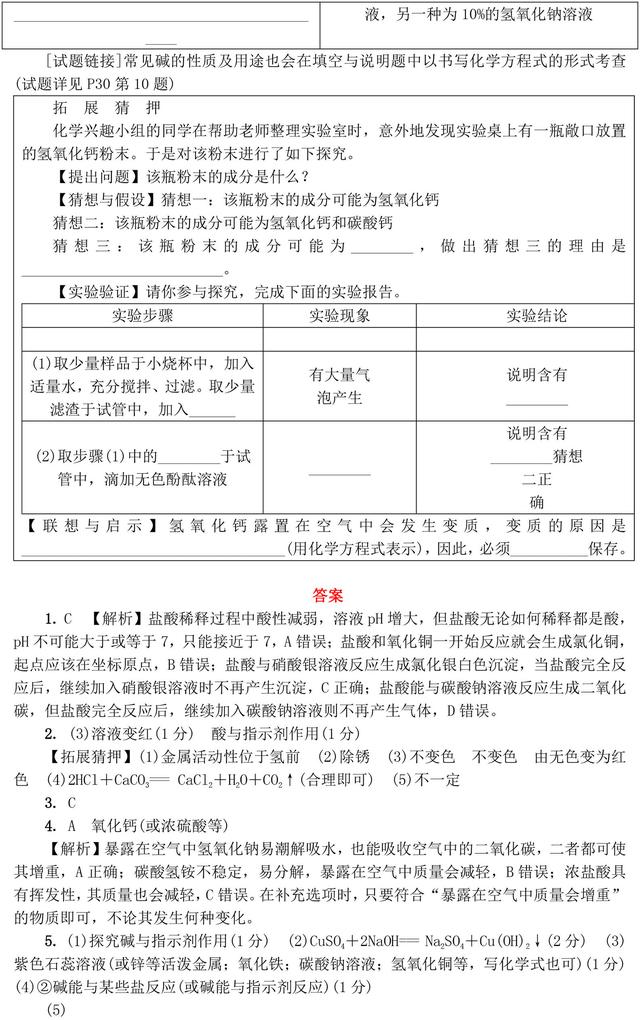
【拓展猜押】【猜想与假设】碳酸钙 氢氧化钙完全变质 【实验验证】稀盐酸 碳酸钙 上层清液 溶液变红 氢氧化钙 【联想与启示】CO2+Ca(OH)2=== CaCO3↓+H2O 密封
 加载中,请稍侯......
加载中,请稍侯......
精彩评论