1、化学与人类生活、生产活动息息相关。请根据所学化学知识回答下列问题:
(1)从保护环境的角度考虑,最理想的燃料是___(填"氢气"或"煤");
(2)在新买的轿车内放入几包活性炭可减少异味,其原理是利用了活性炭的___;
(3)生活中常接触到"高钙牛奶",其中的"钙"应理解为___(填"元素"或"单质")
(4)农业生产中常用于改良酸性土壤的熟石灰的化学式为___;
(5)"84"消毒液的主要成分是次氯酸钠(NaClO),可由反应2NaOH+X=NaClO+NaCl+H2O
制得,则X的化学式为___.
解答:(1)煤燃烧会产生二氧化碳、一氧化碳、二氧化硫等气体,会污染空气,产生温室效应;氢气作为燃料:资源丰富,燃烧时释放出的热量多,燃烧的产物只有水,无污染,是最理想的燃料。
(2)活性炭具有吸附性,能吸附异味和色素,在新买的轿车内放入几包活性炭可减少异味,其原理是利用了活性炭的吸附性。
(3)生活中常接触到"高钙牛奶",其中的"钙"不是以单质、分子、原子等形式存在,这里所指的"钙"是强调存在的元素,与具体形态无关。(4)熟石灰是氢氧化钙的俗称,其化学式为:Ca(OH)2.(5)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式2NaOH+X=NaClO+NaCl+H2O,反应前钠、氢、氧、氯原子个数分别为2、2、2、0,反应后的生成物中钠、氢、氧、氯原子个数分别为2、2、2、2,根据反应前后原子种类、数目不变,则每个X分子由2个氯原子构成,则物质X的化学式为Cl2.
故答案为:(1)氢气;(2)吸附性;(3)元素;(4)Ca(OH)2;(5)Cl2.
2、核电菏数为1~18的元素的原子结构示意图等信息如下,请回答下列间题、
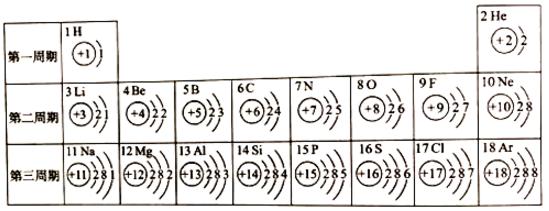
(1)2017年5月9日,中国科学院等单位联合发布了115号元素的中文名为"镆"。此元素原子的核电荷数为______,核外电子数为______。
(2)在第三周期中,随着原子序数的递增,元素原子核外电子排布的变化规律是_________。
(3)利用上表中给出的元素,写出含有氮元素的常见单质、氧化物、酸、键、盐的化学式各一个,并标出所写化学式中氮元素的化合价:单质______、氧化物______、酸______、碱______、盐______。
(4)以钠和氯为例,简述结构与性质的关系。________________________。
(5)国产C919大型客机上使用了大量的铝合金。工业上用电解氧化铝(Al2O3)得到铝和氧气、试计算电解102t氧化铝最多能生成铝的质量是多少?(在答题卡上写出计算过程)
解答:(1)2017年5月9日,中国科学院等单位联合发布了115号元素的中文名为"镆"。此元素原子的核电荷数为115,其核外电子数为115,因为在原子中原子序数=核外电子数=核内质子数;(2)在第三周期中,随着原子序数的递增,元素原子核外电子排布的变化规律是最外层电子数依次递增;(3)含有氮元素的常见单质、氧化物、酸、键、盐的 化学式及氮元素的化合价依次为(4)以钠和氯为例,简述结构与性质的关系。钠元素的原子最外层有一个电子容易失去电子形成阳离子,氯元素的原子最外层有7个电子容易得到电子,形成阴离子,二者结合形成化合物氯化钠;(5)设最多生成金属铝的质量为X
2Al2O3通电4Al+3 O2 ↑
204 108
102t X
204/108=102t/X
X=54t
3、超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意如图:
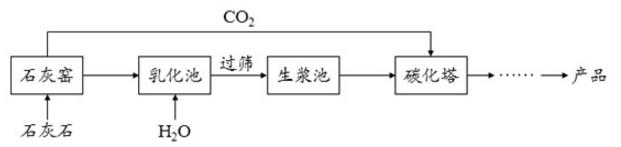
(1)石灰石主要成分的化学式为___.
(2)乳化池中,生石灰与水发生反应,其化学方程式为___.
(3)过筛的目的是拦截___(填"大于"或"小于")筛孔直径的颗粒。
(4)碳化塔中反应的化学方程式为___.
解答:(1)石灰石主要成分是碳酸钙,碳酸钙的化学式为CaCO3.
乳化池中,生石灰与水发生反应生成氢氧化钙,其化学方程式为:CaO+H2O=Ca(OH)2.(3)过筛的目的是拦截大于筛孔直径的颗粒。(4)碳化塔中二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
4、某化学兴趣小组为测定某有机物(含C、H、O三种元素)中各元素的质量比,用下图实验装置(部分夹持装置略去)进行探究。
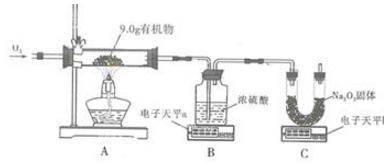
提示:装置C中发生的反应为2Na2O2+2CO2=2Na2CO3+O2
实验数据:
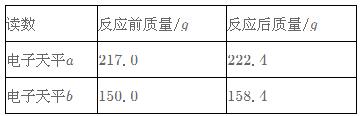
请计算该有机物中各元素的质量比(写出计算过程)。
解答:
2Na2O2+2CO2=2Na2CO3+O2 ∆m
88 32 56
X 8.4g
88/x=56/8.4g x=13.2g
有机物中氢元素质量为:5.4gx1/9=0.6g。有机物中碳元素质量为:13.2gx2/11=3.6g。有机物中氧元素质量为:9.0g-0.6g-3.6g=4.8g。有机物中碳、氢、氧三种元素质量比为3.6g:0.6g:4.8g=6:1:8。
5、探究小组欲从含有FeCl3、CuCl2的废液中回收金属铜,取一定量的废液样品加入少量铁粉,一段时间后铁粉完全溶解,但未发现红色固体沉积。
出现这种现象的可能原因是___;
经查阅资料,铁粉在废液中发生两个化学反应:
①2FeCl3+Fe═3FeCl2 ②CuCl2+Fe═FeCl2+Cu
(2)探究小组另取废液,向废液中加入一定且足量的铁粉至充分反应,溶液变为浅绿色,过滤、干燥,称得固体沉积物质量与加入铁粉质量相等。
①固体沉积物质量与加入铁粉质量相等的原因是___;
②经测定,反应后得到铜的质量为1.6g,其中,反应①消耗铁粉的质量是___,反应②消耗铁粉的质量是___(计算结果精确到0.1).
解答:(1)根据①2FeCl3+Fe═3FeCl2 ②CuCl2+Fe═FeCl2+Cu以及对应的现象可知,铁参加了反应,但是却没有得到铜,说明先发生的是第一个反应,结果铁的质量很少,导致没机会和氯化铜反应,从而没有得到铜;
(2)①2FeCl3+Fe═3FeCl2 这个方程是固体减少的反应;②CuCl2+Fe═FeCl2+Cu这个反应加入56g铁就生成64g的铜,是固体增加的反应。当第一个的减少量和第二个的增加量相等时,固体沉积物质量与加入铁粉质量相等。
②设反应②消耗的铁的质量为y.反应②导致的固体增加量为a
CuCl2+Fe═FeCl2+Cu 固体增加量
56 64 64−56=8
y 1.6g a
56/y=64/1.6g=8/a
y=1.4g a=0.2g
由于固体沉积物质量与加入铁粉质量相等,也就是铜的质量等于加入的全部的铁的质量,所以1.6g−1.4g=0.2g.
或者根据第一个反应固体减少量为加入的铁的质量,等于第二个反应的固体增减量0.2g,所以第一个反应消耗的铁的质量为0.2g.
故答案为:(1)加入的铁先和氯化铁反应,由于铁的量不足,没有来得及和氯化铜反应;
(2)①铁和氯化铁反应固体质量是减少的,而铁和氯化铜反应固体质量是增大的,当两者变化量相同时则固体沉积物质量和加入的铁质量相等;
②0.2g;1.4g.
 加载中,请稍侯......
加载中,请稍侯......
精彩评论