四个离子推断技巧
肯定性原则
根据实验现象推出溶液中肯定存在或肯定不存在的离子(牢记常见的有色离子:Fe2+,Fe3+,Cu2+,MnO4-)
2.互斥性原则
在肯定某些离子的同时,结合离子共存规律,否定一些离子存在(要注意题中的隐含条件,如酸性,碱性,指示剂的变化,与铝反应产生氢气,水的电离情况等)
3.电中性原则
溶液呈电中性,一定既有阳离子,也有阴离子,且溶液中正负电荷总数相等(利用这一原则可确定一些隐含的离子)
4.进出性原则
通常是在实验过程中使用,是指在实验过程中反应生成的离子或引入的离子对后续实验的干扰
典型例题

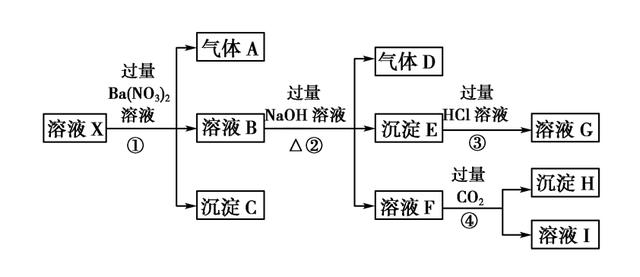

解析:溶液呈强酸性,排除碳酸根与硅酸根离子,则气体A只能由步骤1中发生氧化还原反应产生,即有离子被NO3-氧化,为Fe2+,则排除NO3-离子
剩下的离子能与Ba(NO3)2产生沉淀的只有硫酸根离子,则沉淀为BaSO4,硫酸根离子一定存在,Ba2+离子肯定不存在。溶液B中含有由Fe2+被NO3-氧化得到的Fe3+,因此沉淀E是Fe(OH)3,但不能据此判断溶液X种是否含有Fe2+.。
气体D为氨气,可知溶液X 中有铵根离子,加入CO2有沉淀产生,推断F溶液中含有AlO2-,则溶液中含有Al3+
 加载中,请稍侯......
加载中,请稍侯......
精彩评论