离子反应
【学习目标】
1.了解电解质的概念,了解酸、碱、盐在水溶液中的电离。
2.了解离子反应的概念,了解离子反应发生的条件,并会判断离子在溶液中能否大量共存。
3.能运用书写规则书写常见反应的离子方程式;或结合具体反应对所给离子方程式进行正误判断。
【要点梳理】
要点一、电解质与非电解质
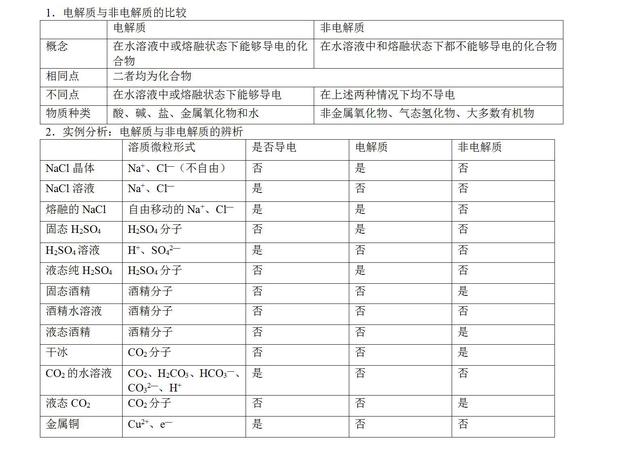
要点诠释:
(1)电解质、非电解质均应是化合物。金属属于单质,故既不是电解质,也不是非电解质。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质应是一定条件下本身电离而导电的化合物;CO2、SO2、SO3、NH3溶于水后也导电,却是与水反应生成新物质后电离而导电的,不是本身电离导电的,故属于非电解质。
(4)能导电的物质并不一定是电解质,如铜、铝、石墨能导电,但因其为单质,故不属于电解质(也不属于非电解质);食盐水能导电,但其为混合物,不属于电解质。溶于水不能导电的物质可能是电解质,如BaSO4难溶于水,但其溶于水的部分是完全电离的,属于电解质。
要点二、强电解质与弱电解质
1.强电解质与弱电解质的比较







 加载中,请稍侯......
加载中,请稍侯......
精彩评论