一、选择题
1、标准状况下有:①6.72 L CH4、②3.01×1023个HCl、③10.8 g H2O、④0.7 mol NH3。下列对这四种气体的大小关系表示不正确的是( A )
A.体积:④>③>②>①B.分子数:④>③>②>①C.氢原子数:④>①=③>②D.质量:②>④>③>①
解析 ①标准状况下,6.72 L甲烷的物质的量是0.3 mol,质量是4.8 g,其中氢原子的物质的量是1.2 mol;②标准状况下,3.01×1023个HCl的物质的量是0.5 mol,质量是18.25 g,其中氢原子的物质的量是0.5 mol;③10.8 g H2O的物质的量是0.6 mol,其中氢原子的物质的量是1.2 mol;④0.7 mol NH3的质量是11.9 g,其中氢原子的物质的量是2.1 mol。标准状况下,水是液态,则根据阿伏加德罗定律可知,体积是④>②>①>③,故A项不正确。
2、分类法是一种行之有效、简单易行的科学方法。下列有关物质分类或归类正确的是( B )
①混合物:漂白粉、王水、Fe(OH)3胶体、冰水混合物
②化合物:CaCl2、NaOH、HCl、HT
③同素异形体:C60、碳纳米管、金刚石、石墨
④电解质:胆矾、碳酸钡、冰醋酸、氧化钾
⑤煤的干馏、煤的气化和煤的液化都属于化学变化
⑥硅酸盐:光导纤维、水晶、玻璃、水泥
A.①②④⑤ B.③④⑤ C.③④⑥ D.①③④⑤⑥
解析 冰水混合物属于纯净物,①错误;HT属于单质,②错误;光导纤维、水晶的主要成分是二氧化硅,不是硅酸盐,⑥错误。
3、下列各组物质相互混合反应后,既有气体生成,最终又有沉淀生成的是( A )
①金属钠投入到FeCl3溶液中 ②过量NaOH溶液和明矾溶液混合 ③少量Ca(OH)2投入到过量NaHCO3溶液中 ④Na2O2投入到FeCl2溶液中
A.只有①④ B.只有③ C.只有②③ D.只有①③④
解析 ①中生成H2和Fe(OH)3沉淀,②中生成NaAlO2,③中生成CaCO3沉淀,④中生成O2和Fe(OH)3沉淀。
4、向含有0.2 mol NaOH和0.1 mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为8.96 L (0 ℃,1.01×105 Pa) 时立即停止,则这一过程中,溶液中离子的物质的量与通入CO2气体的体积关系图像正确的是(气体的溶解和离子的水解忽略不计)( )
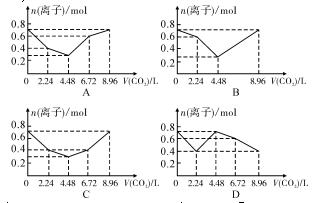
解析 本题涉及的化学反应方程式如下:Ba(OH)2+CO2===BaCO3↓+H2O ①;2NaOH+CO2===Na2CO3+H2O ②;Na2CO3+CO2+H2O===2NaHCO3 ③;BaCO3+CO2+H2O===Ba(HCO3)2 ④。当未通入CO2气体时,溶液中离子的物质的量为0.2 mol Na+、0.1 mol Ba2+、0.4 mol OH-;当通入2.24 L CO2气体时,发生反应①,此时溶液中离子的物质的量为0.2 mol Na+、0.2 mol OH-;当通入4.48 L CO2时,发生反应②,此时溶液中离子的物质的量为0.2 mol Na+、0.1 mol COeq oal(2-,3);当通入6.72 L CO2时,发生反应③,此时溶液中离子的物质的量为0.2 mol Na+、0.2 mol HCOeq oal(-,3);当通入8.96 L CO2时,发生反应④,此时溶液中离子的物质的量为0.2 mol Na+、0.1 mol Ba2+、0.4 mol HCOeq oal(-,3)。
现有部分短周期主族元素的性质与原子(或分子)结构如下表

下列说法正确的是( C )
A.Z的氧化物对应的水化物可以溶于氨水
B.T与氢形成的化合物中不可能含非极性键
C.Y与Z的单质分别与相同浓度的盐酸反应,Y的反应要剧烈些
D.X和Y两元素之间有可能形成共价键
解析 T的最外层电子数是次外层电子数的3倍,次外层电子数为2,最外层电子数为6,所以T为O元素;常温下X的单质为双原子分子,分子中含有3对共用电子对,则X为N元素;Y的M层电子数与K层电子数相同,所以质子数为12,即Y为Mg元素;Z是第三周期元素的简单离子中半径最小,所以Z为Al元素。A项,Z的氧化物对应的水化物为Al(OH)3,不能溶于氨水,错误;B项,T与氢形成的化合物H2O2中含有非极性键,错误;C项,金属性:Mg>Al,则Y与Z的单质分别与相同浓度的盐酸反应,Y的反应要剧烈些,正确;D项,不存在共价键,错误。
6、肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O===O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是( B )
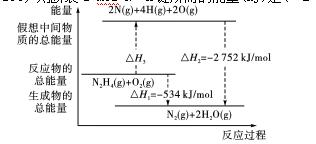
A.194 B.391 C.516 D.658
解析 根据焓变与物质所具有的能量关系可知:ΔH1=ΔH2+ΔH3,由此可求出ΔH3=+2 218 kJ/mol,根据化学键与反应能量的关系可知:ΔH3=1×154 kJ/mol+4×E(N—H)+1×500 kJ/mol,解得E(N—H)=+391 kJ/mol。
硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4===Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( D )
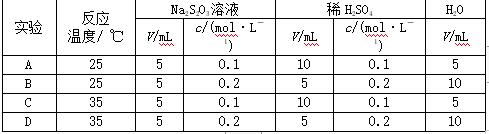
解析 四个实验分别混合后硫酸的浓度都相同,A与C实验Na2S2O3浓度相同,B与D实验Na2S2O3浓度相同,且前者小于后者,而实验D比实验B温度高,故实验D反应速率快,最先出现浑浊。
8、下列关于常温下pH=2的醋酸溶液的叙述正确的是( D )
A.c(CH3COOH)=0.01 mol·L-1
B.c(H+)=c(CH3COO-)
C.加水稀释100倍后,pH=4
D.加入醋酸钠固体,可抑制醋酸的电离
9、下列关于常见有机化合物的说法中,正确的是( B )
A.乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应
B.分子式为C5H12的有机物只有三种,它们互为同分异构体
C.石油、天然气和煤的主要成分都是烷烃
D.己烯和苯都能使溴水褪色,故不能用溴水鉴别己烯和苯
解析 聚乙烯分子结构中无碳碳双键,不能与溴的四氯化碳溶液发生加成反应,A项错误;煤是有机物和无机物组成的复杂的混合物,C项错误;己烯使溴水褪色是由于发生了加成反应,反应后得到的有机层为无色液体,而苯萃取溴水中的溴,得到无色的水层和溴的苯溶液,D项错误。
10、下列操作完全正确的一组是( A )
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过eq (1,3)容积的试管加热
③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤取用放在细口瓶中的液体时,取下瓶塞倒放在桌面上,倾倒液体时,瓶上的标签对着地面
⑥将烧瓶放在桌上,用力塞紧塞子
⑦用坩埚钳夹取加热后的蒸发皿
⑧将胶头滴管垂直伸进试管内滴加液体
⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑩检查装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热
A.①④⑦⑩ B.①④⑤⑦⑩C.①④⑤⑦⑧⑩ D.④⑤⑦⑩
解析 ②给试管中液体加热时,液体的体积不能超过试管容积的eq (1,3),错误;③闻气体的气味时,不能把鼻孔靠近容器口,错误;⑤取用放在细口瓶中的液体时,取下瓶塞倒放在桌面上,倾倒液体时,瓶上的标签应对着手心,防止标签被腐蚀,错误;⑥将烧瓶放在桌上,用力塞紧塞子,容易使烧瓶破裂,错误;⑧滴加液体时,胶头滴管应垂直在试管口上方,错误;⑨稀释浓硫酸时,应将浓硫酸沿着烧杯内壁慢慢注入水中,且不断用玻璃棒搅拌,错误。
11、某有机物X含碳、氢、氧三种元素。欲确定X的分子式,所需下述条件中的最少组合是( C )
①含碳的质量分数 ②含氢的质量分数 ③蒸气的摩尔体积(折合成标准状况下的体积) ④X对H2的相对密度(同温、同压) ⑤X的质量 ⑥X的沸点
A.①②③④⑥B.①③⑥C.①②④ D.①②
解析 根据①②可以确定氧元素的质量分数,进一步可以确定该有机物的实验式,由④可以确定有机物分子的相对分子质量。综上所述,最终可以确定有机物的分子式的最少组合是①②④,C项正确。
二、非选择题
溶液A中存在Ba2+、Fe2+、Al3+、Fe3+、Mg2+、HCOeq oal(-,3)、COeq oal(2-,3)、Cl-、NOeq oal(-,3)、SOeq oal(2-,4)中的五种离子,浓度均为0.1 mol·L-1,溶液体积为1 L。对溶液A进行以下实验,整个过程如图所示(部分产物省略),溶液B与溶液A中所含阴离子种类相同。
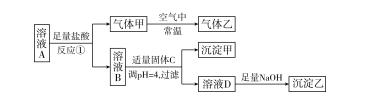
请回答下列问题。
(1)溶液A中含有的阴离子是__Cl-、NOeq oal(-,3)、SOeq oal(2-,4)__。
(2)反应①的离子方程式是__3Fe2++4H++NOeq oal(-,3)===3Fe3++NO↑+2H2O__。
(3)固体C可能是__ABC__(填字母)。
A.MgO B.Mg(OH)Cl
C.MgCO3 D.MgCl2
理由是__Fe3++3H2OFe(OH)3+3H+,消耗H+,平衡正移__(用必要的化学用语及文字表示)。
(4)气体甲、气体乙造成的环境问题有__酸雨或光化学烟雾(合理即可)__(写出其中一个即可)。
(5)若向原溶液中加入足量的NaOH溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体的质量为__12__g。
解析 结合框图分析,HCOeq oal(-,3)和COeq oal(2-,3)能与盐酸反应,生成CO2气体,但是CO2在空气中不能转化为其他气体;Fe2+、NOeq oal(-,3)和H+反应生成NO气体,NO在常温下与空气中的O2反应生成NO2气体,符合题目要求,据此判断溶液A中含有Fe2+、NOeq oal(-,3),因为HCOeq oal(-,3)、COeq oal(2-,3)均不能与Fe2+大量共存,所以溶液A中不存在HCOeq oal(-,3)和COeq oal(2-,3)。因为溶液A和溶液B中所含阴离子种类相同,所以溶液A中必定含有Cl-。又因为溶液A中含有五种离子,且浓度均为0.1 mol·L-1,所以溶液A中含有SOeq oal(2-,4),则一定不含Ba2+。根据电荷守恒知,溶液A中含有的另一种阳离子Mg2+。(5)若向原溶液中加入足量的NaOH溶液,将沉淀过滤、洗涤、干燥并灼烧至恒重,得到的固体为MgO和Fe2O3,根据Mg元素和Fe元素守恒得固体质量为0.1 mol·L-1×1 L×40 g·mol-1+0.1 mol·L-1×1 L×eq (1,2)×160 g·mol-1=12 g。

 加载中,请稍侯......
加载中,请稍侯......
精彩评论