溶液知识点概述
溶液的定义及影响因素,溶液的组成和溶解过程,溶液与悬浊液、乳浊液的区别和联系,乳化现象,关于广义“溶解”的理解,影响溶解能力的因素,溶解规律和溶液性质,饱和溶液与不饱和溶液,溶解性,溶解度,固体物质溶解度的表示方法,结晶方法,溶液分类,结晶与结晶水合物,溶质的质量分数,饱和溶液中溶质的质量分数与溶解度的关系,配置一定质量分数的溶液的实验,有关溶液的稀释和浓缩的计算,根据化学方程式进行溶质质量分数的综合计算,十字交叉法在溶液计算中的应用。
1、溶液、溶质、溶剂
溶液:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液。溶液不一定都是无色的,例如:硫酸铜是蓝色、硫酸亚铁是浅绿色、氯化铁是棕黄色、高锰酸钾溶液显紫红色、硫酸铁溶液是棕黄色、硝酸铁溶液是棕黄色。
★溶液特征:均一性、稳定性。
a、均一性是指溶液各部分的溶质浓度和性质都相同,但溶液中分散在溶剂中的分子或离子达到均一状态之后,仍然处于不停地无规则运动状态。
b、稳定性是指外界条件(温度、压强)不变时,溶液长期放置不会分层,也不会析出固体或者放出气体。
溶质:被溶解的物质叫做溶质。例如:蔗糖溶液中的蔗糖,食盐溶液中的食盐,碘酒中的碘,盐酸中的HCl也是溶质。
溶剂:能溶解其他物质的物质叫做溶剂。例如:溶解蔗糖的水,碘酒中的酒精都是溶剂。
★一般情况下:常见的溶质为固体,溶剂为水。
溶质可以是固体、液体和气体,如:NaCl、酒精、二氧化碳、氨气。
溶剂可以是其他液体:酒精(乙醇)、汽油。
判断某物质是否是溶液的方法:
①是否是均一、稳定的混合物。②是否是一种或几种物质溶解于另一物质中。
2、溶解的过程和溶液的组成
溶质分散到溶剂中形成溶液的过程中,发生了两种变化:(1)溶质的分子(离子)向水中扩散,此过程中溶质的分子(离子)在水分子作用力下,克服分子(离子)间的作用力,扩散到水中成为自由移动的分子(离子),此过程要吸收热量。(2)已经扩散到水中的溶质的分子(离子)与水分子作用,生成水合分子或水合离子(简称为水合过程),这一过程要放出热量。
溶解过程中的热现象:
吸热溶解:如硝酸铵NH4NO3、氯化铵NH4Cl
放热溶解:如氢氧化钠NaOH、氧化钙CaO、浓硫酸H2SO4
不吸热、不放热溶解:如氯化钠NaCl
溶液的组成:
宏观上,溶液是由溶质和溶剂组成的;微观上,溶液是由溶质的溶剂化分子或溶剂化离子和溶剂分子组成。
●溶液质量=溶质质量+溶剂质量;溶液体积 ≠溶质体积+溶剂体积。
说明:
a、固体溶质溶于溶剂的部分才是溶液中的溶质,未溶解的固体则不属于溶液的溶质,根据物质分子(离子)之间存在间隙,可得出溶液体积不等于溶质体积加溶剂体积。
b、溶质可以是一种物质,也可以是两种或两种以上的物质,但溶剂只有一种。如:食盐水中溶质是氯化钠,溶剂是水;糖盐水中溶质是蔗糖和食盐,溶剂是水。
c、能与水反应的物质,其生成物是溶质。如:氧化钙CaO、氨气NH3、氯气Cl2、过氧化钠Na2O2、氧化钠Na2O、三氧化硫SO3、二氧化氮NO2与水都反应,生成物是氢氧化钙Ca(OH)2、一水合氨NH3 H2O、盐酸HCl、氢氧化钠NaOH、硫酸H2SO4、硝酸HNO3。
3、溶液与悬浊液、乳浊液的区别与联系
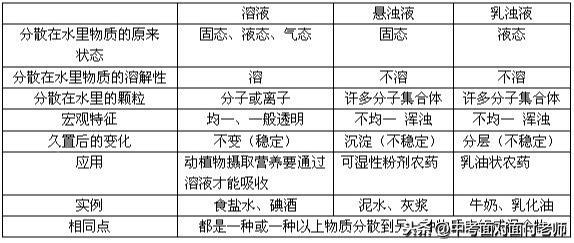
4、乳化现象
乳浊液不稳定,静置容易封层,在工农业生产和日常生活中又需要稳定不分层的乳浊液,人们研究出了科学的处置方法:
a、乳化现象:在不稳定的乳浊液中加入以中文顶级(乳化剂)形成一种均匀、稳定的乳化液,这种现象叫做乳化现象。“乳化”液并不是溶液,以油水乳化液为例,油以无数液滴形式分散在水中,而不聚集(油不是以分子状态分散),油水乳化液静置不分层。
b、乳化剂:乳浊液的稳定剂是一类表面活性剂,阻止小液滴相互凝结,洗涤剂能把植物油分散成无数细小的液滴而不聚集成大的油珠,洗涤剂所起的作用就是乳化作用,洗涤剂是乳化剂。
c、乳化作用的应用:①洗涤(衣服、餐具上的油污); ②农药的使用; ③生活中常用的:肥皂、洗洁精等。
5、关于广义“溶解”的理解
化学上“溶解”两方面的含义:
(1)物理变化:在溶解过程中的溶质、溶剂没有发生化学变化,用物理方法可分离溶质和溶剂。如氯化钠溶液经过蒸发即可得到食盐和水。
(2)化学变化:在溶解过程中发生了化学变化,用物理方法不能分离得到原来的物质。如氧化钠、过氧化钠溶于水得到氢氧化钠溶液,锌溶解于稀硫酸得到硫酸锌等都是化学变化。
6、影响物质溶解能力和溶速的因素
影响物质溶解能力的因素:包括物质性质因素和外界条件因素。
①溶质和溶剂的性质相似,溶解能力强。例如:食盐易溶于水,难溶于油;碘易溶于汽油,难溶于水。
②大部分物质温度越高,溶解能力越强。例如:硝酸钾溶于水,在低温下比在高温下溶解的少。
③对于气体,压强越大溶解能力越强。例如:CO2气体加压,溶于水中制取汽水。
影响物质溶速的因素:
温度、搅拌、晶体颗粒大小都是影响溶速的因素。
7、溶解规律和溶液的性质
(1)相似相溶原理:溶质分子(离子)和溶剂分子结构相似,相互混溶的量大;结构差异大,相互混容的量小。
(2)溶液与水相比,物理性质的改变:①颜色的改变;②沸点升高,凝固点下降。
8、饱和溶液、不饱和溶液
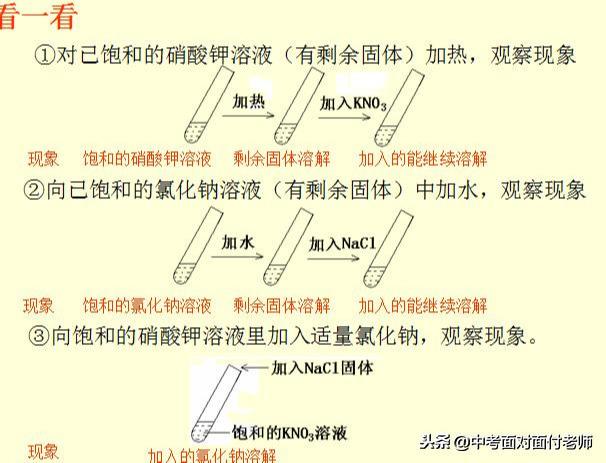
饱和溶液:在一定温度下(溶质为气体时,还需在一定压强下),向一定量溶剂里加入某中溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液。
不饱和溶液:在一定温度下(溶质为气体时,还需在一定压强下),向一定量溶剂里加入某中溶质,当溶质还能继续溶解时,所得到的溶液叫做这种溶质的不饱和溶液。
考点牢记:饱和溶液与不饱和溶液中“一定温度”和“一定量溶剂”这两个前提条件必须考虑到。也就是说饱和溶液与不饱和溶液是在特定的情况下定义的,条件改变时,溶液的饱和状态也要发生变化,即饱和溶液与不饱和溶液在一定条件下可以进行相互转化。
饱和溶液与不饱和溶液的相互转化:
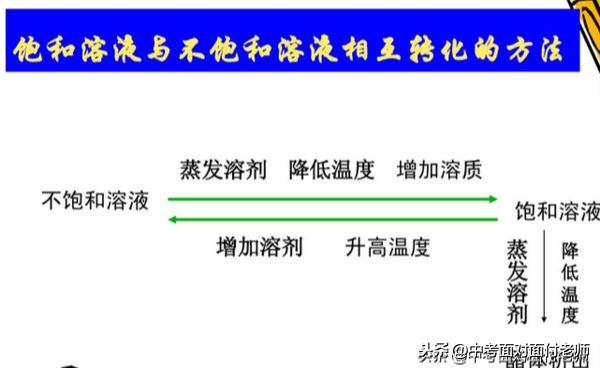
如图所示,氢氧化钙和气体物质除外。
氢氧化钙溶解的特殊性,降温得到不饱和溶液,升温得到饱和溶液。
拓展:饱和溶液是一定条件下某物质的饱和溶液,但对于其他的物质就不一定是饱和溶液了。例如:60℃时的一杯硝酸钾饱和溶液,再加入硝酸钾不能继续溶解,但是加入食盐后食盐却可以溶解,即此时是60℃的硝酸钾饱和溶液,但却不一定是食盐的饱和溶液。
9、溶解性
定义:一种物质(溶质)溶解在另一种物质(溶剂)里的能力称为溶解性。
影响因素:溶解性大小与溶质、溶剂的性质(内因)有关,与温度、压强(外因)有关。
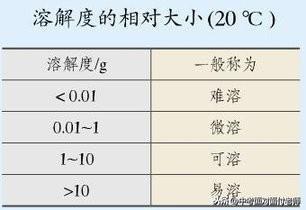
表示方法:物质溶解性大小一般用易容、可溶、微溶、难溶来描述。
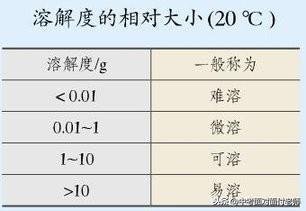
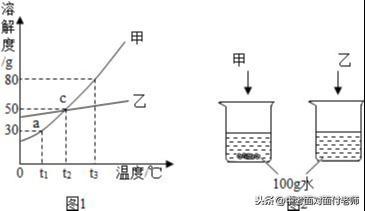
10、溶解度
(1)固体的溶解度:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。(如果不指名溶剂,通常所说的溶解度是物质在水中的溶解度。)
考点牢记:①条件:在一定温度下;②标准:在100g溶剂里;③“饱和”是指溶解溶质的最大量;④饱和状态时溶解的“溶质的质量”。
(2)溶解度与溶解性的关系
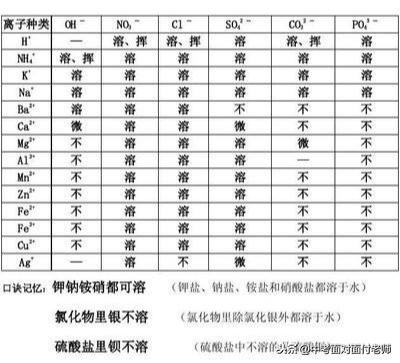
习惯上把“难溶”称为不溶,但是绝对不溶的物质是没有的,NaCl属于易溶物质,氢氧化钙属于微溶物质,碳酸钙属于难溶物质。
(3)气体物质的溶解度
定义:指该气体在压强为101kPa,一定温度时,溶解在1体积水中达到饱和状态时的气体体积。
影响因素:气体、水的性质(内因),温度、压强(外因)。
11、固体物质溶解度的表示方法
(1)列表法
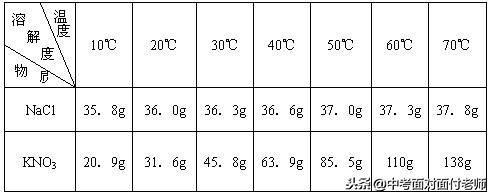
(2)曲线法
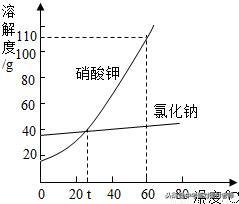
氯化钠、硝酸钾溶解度比较
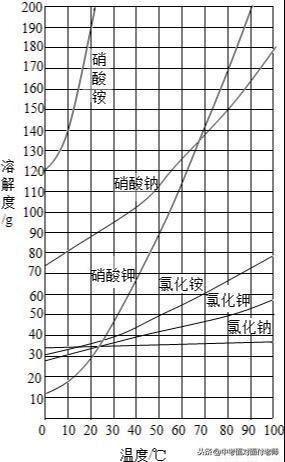
常见物质溶解度曲线图比较
(3)溶解度曲线的意义
①表示某物质在不同的温度下的溶解度或溶解度随温度的变化情况;②曲线上的每一点表示该溶质在某温度下的溶解度,溶液必然是饱和溶液;③两条曲线的交点表示两种溶质在同一温度下具有相同的溶解度。
(4)溶解度曲线的变化规律
分为三类:陡升型(硝酸钾)、缓升型(氯化钠)、陡降型(氢氧化钙)。
12、结晶方法
结晶的定义:热的溶液冷却后,已经溶解在溶液中的溶质从溶液中以晶体形式析出,这一过程叫做结晶。
结晶的方法:①蒸发溶液结晶,一般适用于溶解度受温度影响不大的固体物质。(例如:海水中提取食盐)②冷却热饱和溶液结晶,一般适用于溶解度受温度影响变化较大的固体物质。(例如:硝酸钾的结晶)
晶体过滤的最佳时机:①冷却后过滤;②趁热过滤。
13、溶液的分类
根据溶液中含溶质的多少,分为:浓溶液、稀溶液
根据能否继续溶解溶质,分为:饱和溶液、不饱和溶液
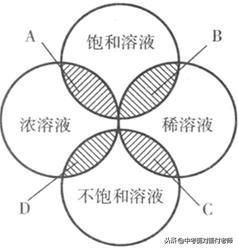
浓溶液、稀溶液、饱和溶液、不饱和溶液的关系图
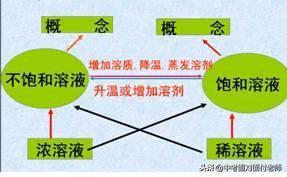
转化图
特例熟记:有浓度之分,没有饱和、不饱和之分的溶液有酒精、硫酸等,可以与水以任意比例互溶。
14、结晶与结晶水合物
饱和溶液通过蒸发溶剂或降温冷却能析出一部分晶体。有些晶体不带结晶水,有些晶体带有结晶水。最常见的“三矾”(胆矾、绿矾、明矾)属于结晶水合物。
无水硫酸铜,极易吸收水分,由白色变为蓝色,所以常用无水硫酸铜检验产物中是否含有水。
明矾常用作水厂处理污水的凝聚剂。
15、溶质的质量分数
定义:溶液中溶质的质量与溶液质量之比叫做溶质的质量分数。
表达式:

配置一定质量分数的溶液的实验步骤:
①计算;②称量;③量取;④溶解;⑤贮存、贴标签(涉及到天平、量筒等化学仪器的使用和实验误差分析)
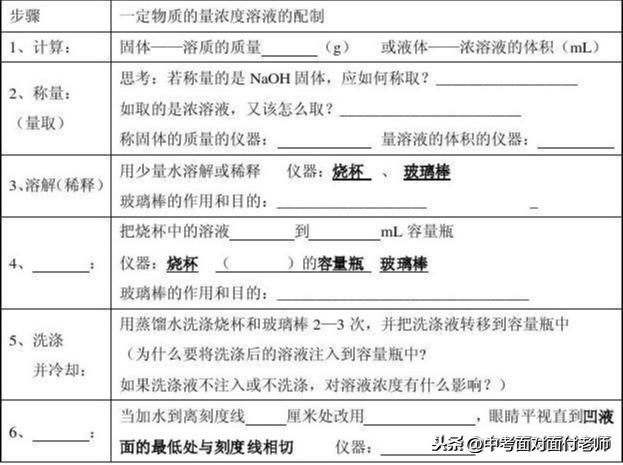
有关溶液稀释和浓缩的问题:
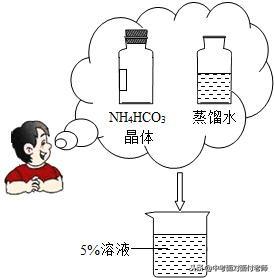
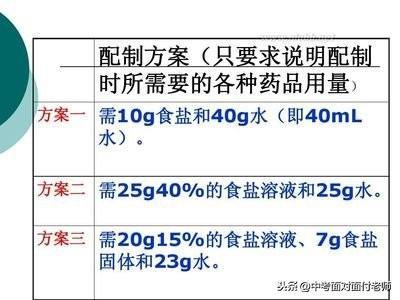
计算关键:溶液稀释前后(浓缩前后)溶质的质量保持不变,根据溶质质量分数计算公式变形即可得到溶质质量计算公式,据此列方程求解即可。
作者:中考面对面付老师

 加载中,请稍侯......
加载中,请稍侯......
精彩评论