一、反应热的四种计算方法
1.利用热化学方程式进行相关量的求解,可先写出热化学方程式,再根据热化学方程式所体现的物质与物质间、物质与反应热间的关系直接或间接求算物质的质量或反应热。其注意的事项有:
(1)反应热数值与各物质的化学计量数成正比,因此热化学方程式中各物质的化学计量数改变时,其反应热数值需同时做相同倍数的改变。
(2)热化学方程式中的反应热是指反应按所给形式完全进行时的反应热。
(3)正、逆反应的反应热数值相等,符号相反。
2.根据盖斯定律,可以将两个或两个以上的热化学方程式包括其ΔH相加或相减,得到新的热化学方程式,可进行反应热的有关计算。其注意的事项有:
(1)热化学方程式同乘以某一个数时,反应热数值也必须乘上该数。
(2)热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减。
(3)将一个热化学方程式颠倒时,ΔH的“+”、“-”号必须随之改变。
3.根据燃烧热计算:可燃物完全燃烧产生的热量=可燃物的物质的量×燃烧热。
4.根据键能计算:反应热(焓变)等于反应物中的键能总和减去生成物中的键能总和,ΔH=∑E反-∑E生(E表示键能)。如反应3H2(g)+N2(g)⇋2NH3(g) ΔH=3E(H—H)+E(N≡N)-6E(N—H)。
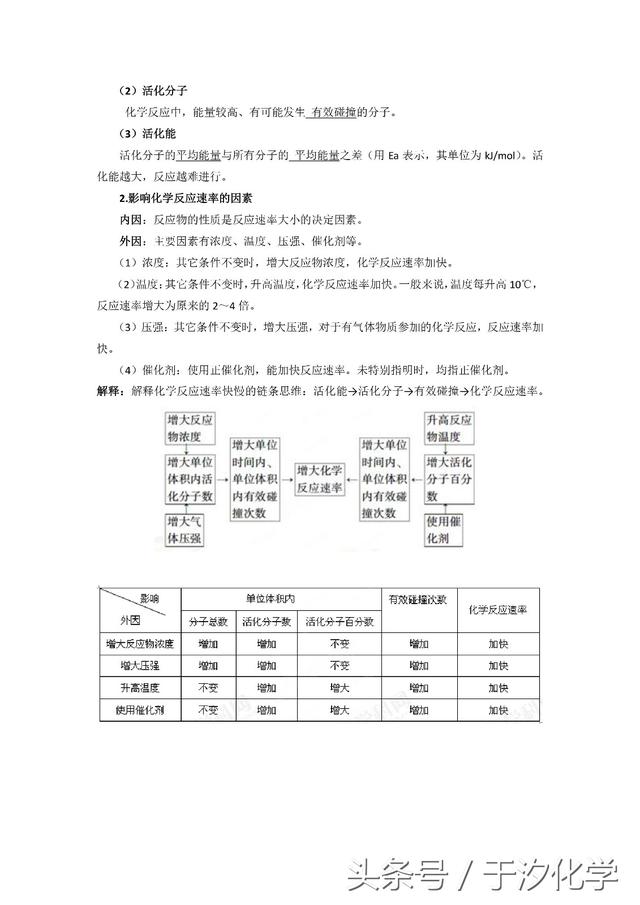
二、外界条件对化学反应速率的影响规律
影响化学反应速率的因素包括内因和外因。内因是指反应物本身的性质;外因包括浓度、温度、压强、催化剂、反应物颗粒大小等。这些外界条件对化学反应速率影响的规律和原理如下:
1.浓度
(1)浓度增大,单位体积内活化分子数增多(活化分子百分数不变),有效碰撞的几率增加,化学反应速率增大。
(2)浓度改变,可使气体间或溶液中的化学反应速率发生改变。固体或纯液体的浓度可视为常数,它们的物质的量的变化不会引起反应速率的变化,但固体颗粒的大小会导致接触面积的变化,故影响化学反应速率。
2.压强
改变压强,对化学反应速率产生影响的根本原因是引起浓度的改变。对于有气体参加的反应体系,有以下几种情况:

(3)等:指“v正=v逆≠0”。即某一物质在单位时间内消耗的物质的量浓度和生成的物质的量浓度相等,也可以用不同物质的化学反应速率表示该反应的正、逆反应速率相等。
(4)定:指参加反应的各组分的含量保持不变,即各组分的浓度、质量分数、体积分数(有气体参加的可逆反应)、反应物的转化率等均保持不变。
(5)变:指平衡移动。可逆反应的平衡状态是相对的、暂时的,当外界某一条件改变时,原平衡被破坏,化学平衡向着减弱这种改变的方向移动,在新的条件下达到新的平衡状态。
理解感悟 “一定条件”、“可逆反应”是前提,“相等”是实质,“保持不变”是标志。
2.化学平衡状态判断的“四大依据”
(1)对于普通可逆反应,以2SO2(g)+O2(g) ⇋2SO3(g)为例:
若各组分的物质的量、浓度不发生变化,则反应已达到平衡状态。若用反应速率关系表示化学平衡状态,式中既要有正反应速率,又要有逆反应速率,且两者之比等于化学计量数之比,就达到化学平衡状态。
(2)对于有有色气体存在的反应体系,如2NO2(g) ⇋N2O4(g)等,若体系的颜色不再发生改变,则反应已达平衡状态。
(3)对于有气体存在且反应前后气体的物质的量发生改变的反应,如N2(g)+3H2(g) ⇋2NH3(g),若反应体系的压强不再发生变化、平均相对分子质量不再变化,则说明反应已达平衡状态。
对有气体存在且反应前后气体物质的量不发生改变的反应,反应过程中的任何时刻体系的压强、气体的总物质的量、平均相对分子质量都不变,故压强、气体的总物质的量、平均相对分子质量不变均不能说明反应已达平衡状态。
(4)从微观的角度分析,如反应N2(g)+3H2(g) ⇋2NH3(g),下列各项均可说明该反应达到了平衡状态。
①断裂1 mol N≡N键的同时生成1 mol N≡N键。
②断裂1 mol N≡N键的同时生成3 mol H—H键。
③断裂1 mol N≡N键的同时断裂6 mol N—H键。
④生成1 mol N≡N键的同时生成6 mol N—H键。
特别提示 (1)从反应速率的角度来判断反应是否达到平衡时,速率必须是一正一逆(不能同是v正或v逆),且反应速率之比等于化学计量数之比。
(2)在可逆反应过程中,能发生变化的物理量(如各组分的浓度、反应物的转化率、混合气体密度、颜色、平均摩尔质量等),若保持不变,说明可逆反应达到了平衡状态。
四、化学平衡移动及其移动方向的判断
1.化学平衡移动的分析判断方法


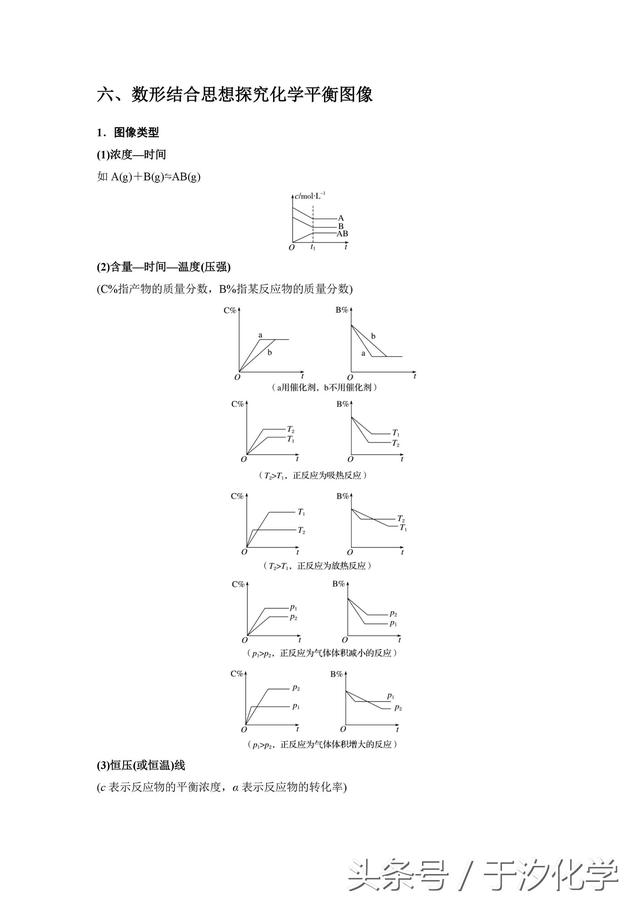


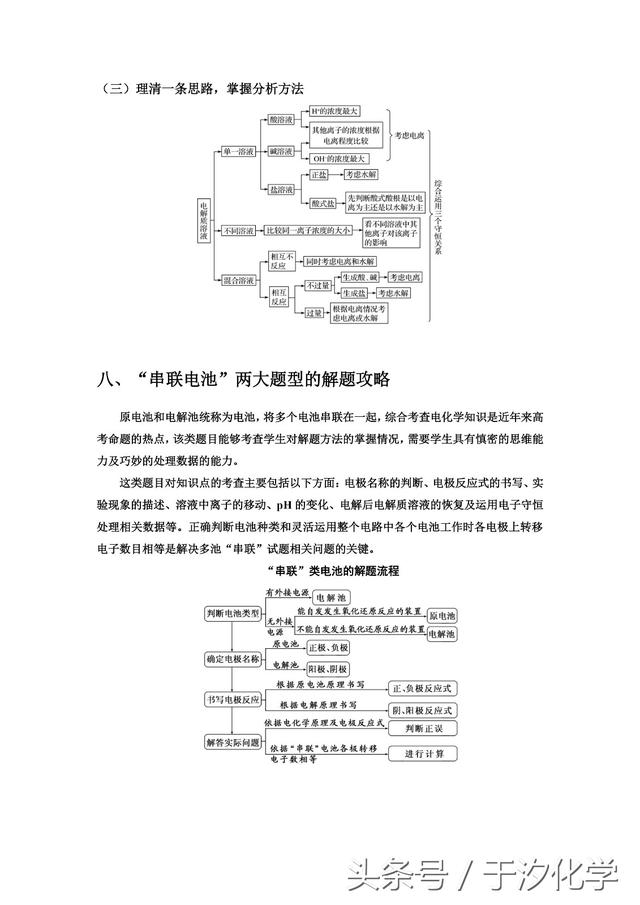

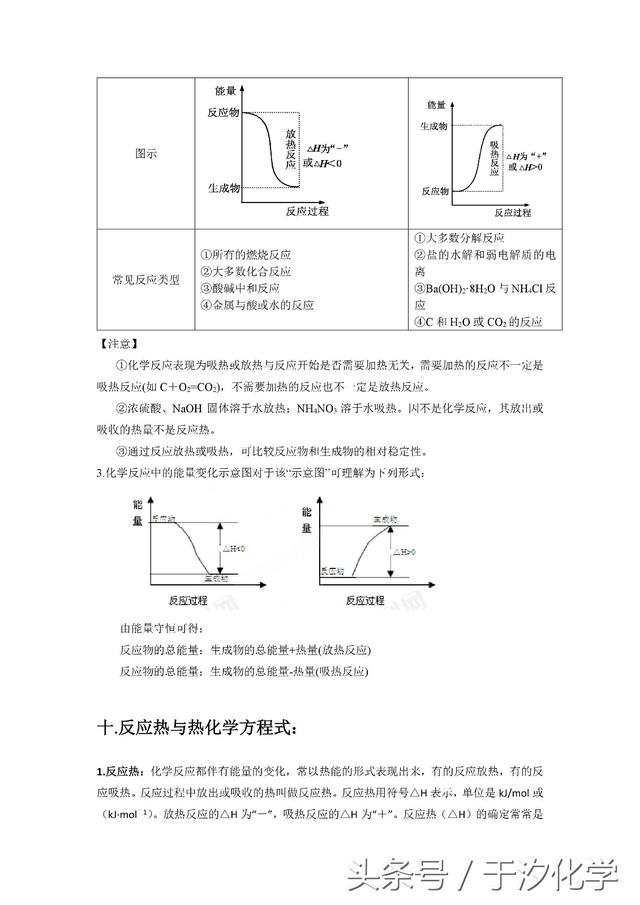

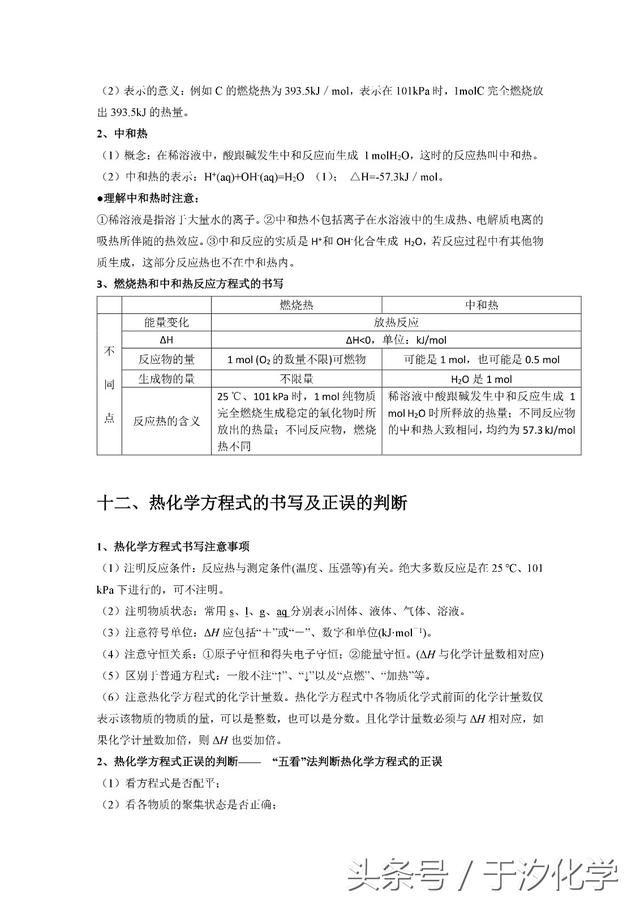



二十.强电解质与弱电解质的区别
(一)电解质和非电解质
电解质:在水溶液里或熔融状态下能导电的化合物。
非电解质:在水溶液里或熔融状态下不能导电的化合物。
【注意】
1.电解质和非电解质的范畴都是化合物,所以单质既不是电解质 也不是非电解质。
2.化合物为电解质,其本质是自身能电离出离子,有些物质溶于水时所得溶液也能导电,但这些物质自身不电离,而是生成了一些电解质,则这些物质不属于电解质。如:SO2、SO3、CO2、NO2等。
3.常见电解质的范围:酸、碱、 盐、离子型氧化物。
4.溶剂化作用:电解质溶于水后形成的离子或分子并不是单独存在的,而是与水分子相互吸引、相互结合,以“水合 离子”或“水合分子”的形态存在,这种溶质分子或离子与溶剂相互吸引的作用叫做溶剂作用。
(二)强电解质和弱电解质
强电解质:在溶液中能够全部电离的电解质。则强电解质溶液中不存在电离平衡。
弱电解质:在溶液中只是部分电离的电解质。则弱电解质溶液中存在电离平衡。
【注意】
1.强、弱电解质的范围:
强电解质:强酸、强碱、绝大多数盐
弱电解质:弱酸、弱碱、水
2.强、弱电解质与溶解性的关系:
电解质的强弱取决于电解质在水溶液中是否完全电离,与溶解度的大小无关。一些难溶的电解质,但溶解的部分能全部电离,则仍属强电解质。如:BaSO4、BaCO3等。
3.强、弱电解质与溶液导电性的关系:
溶液的 导电性强弱与溶液中的离子浓度大小有关。强电解质溶液的导电性不一定强,如很稀的强电解质溶液,其离子浓度很小,导电性很弱。而弱电解质溶液的导电性不一定弱,如较浓的弱电解质溶液,其电离出的离子浓度可以较大,导电性可以较强。
4.强、弱电解质与物质结构的关系:
强电解质一般为离子化合物和一些含强极性键的共价化合物,弱电解质一般为含弱极性键的化合物。
5.强、弱电解质在熔融态的导电性:
离子型的强电解质由离子构成,在熔融态时产生自由移动的离子,可以导电。而共价型的强电解质以及弱电解质由分子构 成,熔融态时仍以分子 形式存在,所以不导电。
二十一.弱电解质的电离平衡
1.弱电解质的电离平衡指在一定条件下(温度、浓度),弱电解质电离成离子的速率和离子 结合成分子的速率相等时的状态。弱电解质的电离平衡的特点是:
(1)动态平衡:电离方程式中用“ ”,如:CH3COOH CH3COO-+H+。[来源:学&科&网Z&X&X&K]
(2)条件改变:平衡被打破。如在CH3COOH的石蕊溶液中(呈红色)加入固体CH3COONH4,即增大了c(CH3COO-),平衡左移,c( H+)变小,使红色变浅。
(3)弱电解质在离子反应中电离平衡发生移动。将等质量的锌粉分别投入10mL0.1mol/L盐酸和10mL0.1mol/L醋酸中,实验结果:盐酸的反应速率比醋酸快。若锌足量,则产生氢气的体积相等。因为当浓度和体积相同时,盐酸是强酸,c(H+)大,所以反应 速率快,但二者可电离出来的H+的物质的量相等,仅仅是后者随着反应的进行,醋酸的电离平衡不断发生移动。
(4)从导电实验可知,弱电解质少部分电离 ,大部分以分子形式存在,决定了它在离子方程式书写中保留分子形式。如醋酸和烧碱溶液中和反应的离子方程式应写成:CH3COOH+OH—= CH3COO—+H2O。
(5)导电性强弱与电解质强弱的关系:电解质的强弱由物质内部结构决定,电解质的强弱在一般情况下影响着溶液导电性的强弱。导电性强弱是由溶液离子浓度大小决定的。如果某强电解质溶液浓度很小,那么它的导电性可以很弱,而某弱电解质虽然电离程度很小,但如果浓度较大时,该溶液的导电能力也可以较强。因此,强电解质溶液的导电能力不一定强,弱电解质的导电能力也不一定弱。
2.电离平衡常数
(1)概念:在一定条件下,弱电解质的电离达到平衡时,溶液中电离所产生的各种离子浓度的乘积跟溶液中未电离的分子浓度的比是一个常数,这个常数叫做电离平衡常数,用K表示(酸用Ka表示,碱用 Kb表示)。
(2)表示方法:AB A++B- K=c(A+) c(B-)c(AB)
(3)K的意义:K值越大,表示该电解质较易电离,所对应的弱酸弱碱较强。从Ka或Kb的大小,可以判断弱酸和弱碱的相对强弱,例如弱酸的相对强弱: H2SO3(Ka1=1.5×10-2)> H3PO4(Ka1=7.5×10-3)>HF(Ka=7.2×10-4)> HN O2(Ka1=4.6×10-4)> HCOOH(Ka=1.8×10-4)> CH3COOH(Ka=1.8×10-5)> H2CO3(Ka1=4.3×10-7)> H2S(Ka1=9.1×10-8)
(4)影响K值大小的因素:K值不随浓度 而变化,但随温度而变化。
(5)多元弱酸的电离。多元弱酸是分步电离的,且越向后的电离越困难,其电离出来的离子浓度也越小,酸性主要由第一步电离决定。如 H3PO4的电离:
第一步电离:H3PO4 H++H2PO-4 K1
第二步电离:H2PO-4 H++HPO2-4 (较难) K2
第三步电离:HPO2-4 H++PO3-4 (困难) K3
显然: K 1>K2>K3。在磷 酸溶液中,由H3PO4电离出来的离子有H+、H2PO-4 、HPO2-4 、PO3-4 等离子,其离子浓度的大小关系为:c(H+)>c(H2PO-4 )>c(HPO2-4 )>c(PO3-4 ) 。
二十二、影响电离平衡的因素
1.内因:弱电解质本身,如常温下K(HF)>K(CH3COOH)。
2外因:以CH3COOH CH3COO-+H+ 为例
(1)温度
弱电解质的电离过程一般是吸热的,升高温度,电离平衡向右移动,CH3COOH电离程度增大,c(H+)、c(CH3COO-)增大。
(2)浓度
加水稀释CH3COOH溶液,电离平衡向右移动,电离程度增大。n(CH3COO-)、n(H+)增大,但c(CH3COO-)、c(H+)减小。
(3)同离子效应
在弱电解质溶液中加入同弱电解质具有相同离子的强电解质,电离平衡向逆反应方向移动。例如:0.1 mol/L的醋酸溶液中存在如下平衡CH3COOH CH3COO-+H+。加入少量CH3COONa固体或HCl,由于增大了c(CH3COO-)或c(H+),使CH3COOH的电离平衡向逆反应方向移动。前者使c(H+)减小,后者使c(H+)增大。
(4)化学反应
在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质时,可使电离平衡向电离的方向移动。例如,在CH3COOH溶液中加入NaOH或Na2CO3溶液,由于OH-+H+=H2O、CO2-3 +2H+= H2O+CO2↑,使c(H+)减小,平衡向着电离的方向移动。
〖点拨〗:稀释弱电解质溶液时,平衡移动的方向易误判为逆向移动,把溶液中离子浓度的减小误认为是电离平衡逆向移动造成的,实际上稀释才是造成溶液中离子浓度减小的主要因素。
二十三.水的电离及离子积常数
1.水的电离平衡:水是极弱的电解质,能发生自电离:
H2O H++OH- (正反应为吸热反应)
2.水的离子积常数:Kw= c(H+)c(OH-)
250C 时 Kw =1.0×10-14 mol2·L-2 ,水的离子 积与温度有关,温度升高Kw增大。
如1000C 时Kw =1.0×10-12 mol2 ·L-2 .
3.无论是纯水还是酸、碱,盐等电解质的稀溶液,水的离子积为该温度下的Kw。

 加载中,请稍侯......
加载中,请稍侯......
精彩评论