高一化学第二学期第一次月考试卷
(满分100 时间90分钟)
一、 单项选择题(每个小题3分,共15个小题,共45分)
1.
C-NMR(核磁共振)可以用于含碳化合物的结构分析,有关说法正确的是( )
A.质子数为6 B.电子数为13 C.中子数为6 D.质量数为6
2、甲、乙是同一主族的两个元素,若甲的原子序数为Z,则乙原子序数不可能为 ( )
A、Z+2 B、Z+4 C、Z+8 D、Z+18
3、元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化 B.元素原子量依次递增
C.元素原子最外层电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
4、在元素周期表中金属元素与非金属元素的分界线附近的一些元素能用于制
A.合金 B.半导体 C.催化剂 D.农药
5.下列气体和液体的组合中不可能形成喷泉的是( )
A.HCl和H2O B.O2和H2O
C.NH3和H2O D.CO2和NaOH溶液
6. 实验室制备氨气,下列方法中适宜选用的是( ).
A.固态氯化铵加热分解 B.氢氧化钠溶液中滴加稀氨水
C.氯化铵溶液与氢氧化钠溶液共热 D.固态氯化铵与氢氧化钙混合加热
7.为验证浓硫酸与碳反应的气体产物中含SO2和CO2,通常是让气体通过品红溶液,然后通过KMnO4溶液,最后通过澄清石灰水,在这过程中SO2和CO2表现出的性质是( )
①SO2的漂白性;②SO2的氧化性;③SO2的还原性;④SO2酸性氧化物;⑤CO2酸性氧化物;
⑥CO2的氧化性。
A.①③⑤ B.①②④⑤ C.②③⑤⑥ D.①④⑤⑥
8.已知元素的原子序数,可以推知原子的①中子数 ②核电荷数 ③核外电子数 ④在周期表中的位置,其中正确的是( )
A.①③ B.②③ C.①②③ D.②③④
9.某元素最高正价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为( )
A. HX B. H2X C. XH3 D. XH4
10. 下列属于同位素的一组是 ( )
A.O2、O3 B.Na2O、Na2O2 C.、 D.H、D、T
11、某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断
A.R一定是第四周期元素 B.R一定是ⅣA族元素
C.R的气态氢化物比同周期其他元素气态氢化物稳定 D.R气态氢化物化学式为H2R
12.砷为第4周期第ⅤA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是( )
A.砷在通常情况下是固体 B.可以存在-3、+3、+5等多种化合价
C.As2O5对应水化物的酸性比H3PO4弱 D.砷的氧化性比磷强
13.同周期的X、Y、Z三元素, 其最高价氧化物水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4, 则下列判断正确的是
A.原子半径 X>Y>Z B.非金属性 X>Y>Z
C.阴离子的还原性按X、Y、Z的顺序由强到弱
D.气态氢化物的稳定性按X、Y、Z的顺序由弱到强
14..aXn-和bYm+为两主族元素的离子, 它们的电子层结构相同, 下列判断错误的是( )
A.原子半径X<Y B.a+n=b-m
C.离子半径X n-<Y m+ D.X的氢化物的化学式为HnX
15、下列各组顺序的排列不正确的是( )
A.离子半径:F->Na+>Mg2+>Al3+
B.热稳定性:HCl>H2S>PH3>AsH3
C.酸性强弱:H3AlO3<H2SiO3<HClO3<H3PO4
D.碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3
二、填空题(共5题,共55分)
16、(方程式3分,第二空2分,其他各1分,共11分)
(1)实验室制备氨气的化学方程式
检验氨气的实验操作及现象 (2分)
(2)金属铜和浓硫酸的化学反应方程式
如何检验产生的气体
(3)写出S2- 的结构示意图
写出质量数为24,中子数为12离子符号
17、(每空1分,共12分)按要求填表
元素 1 2 3 4
原子序数 9 11 16 26
元素符号
周期
族
18、(每空1分,共12分)在原子序数为1~20的元素中,用适当的化学符号填写下列空白(稀有气体除外)。
(1)原子半径最小的元素是________;原子半径最大的元素是________;氧化性最强的单质是________;还原性最强的单质是________。
(2)最高价氧化物对应水化物中碱性最强的化合物是________;最高价氧化物对应水化物中酸性最强的化合物是________;最高价氧化物对应水化物中呈两性的化合物是________;最稳定的气态氢化物是________;水溶液呈碱性的气态氢化物是________。
(3)地壳中含量最多的金属元素是________;单质硬度最大、熔沸点最高,形成化合物种类最多的元素是________;工业上常用作半导体材料的元素是________。
19、(方程式3分,其他各1分,共8分)A 、B、C、D为具有相同电子层数的四种元素.已知:0.2mol A与酸充分反应后可生成2.24 L H2(标准状况);B原子的最外层电子数比最内层电子数多1个;C、D离子的电子层结构与氩原子相同;C在点燃时与氧气反应生成的氧化物,它是引起自然界中酸雨形成的主要原因;D单质常温时为气态.
(1)A、B、C、D的元素名称分别为A ,B ,C ,D ;
(2)B的氢氧化物与Mg(OH)2可用试剂_______鉴别,
离子方程式为_
20、(方程式3分,其他各1分,共12分)回答下列问题。
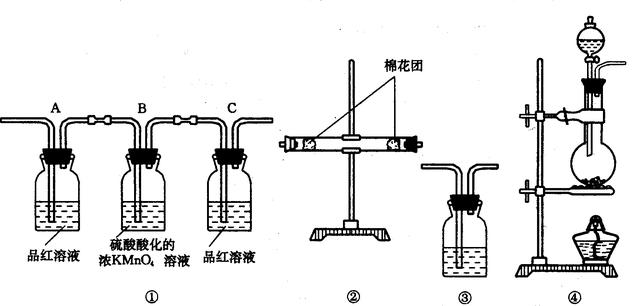
(1)浓硫酸与木炭在加热条件下反应的化学方程式是_ _______________________________
(2)试用下图所列各种装置设计一个实验来验证上述反应所产生的各种产物。
这些装置的连接顺序,按产物气流从左到右的方向是(填装置的编号):
___ ___→________→________→__________。
(3)实验时可观察到装置①中A瓶的溶液褪色c瓶的溶液不褪色。
A瓶溶液的作用是________________________________________,
B瓶溶液的作用是______________________________________,
C瓶溶液的作用是__________________________________________。
(4)装置②中所装的固体药品是______________,可验证的产物是_________

 加载中,请稍侯......
加载中,请稍侯......
精彩评论