方法5 电解质溶液方面试题的解题方法与技巧
5、本策略内容主要包括:弱电解质的电离平衡、水的电离和溶液的pH、盐类的水解三部分。从近十年的高考试卷来看,水的电离与溶液pH的求算、溶液中离子浓度大小的比较、离子共存,是高考中常考不衰的热点内容。随着人们对环境保护意识的增强,有关与溶液有关的废水分析与处理问题,将会与离子共存、pH求算及中和滴定一起融入未来的高考试题中。
(1).弱电解质的电离平衡
可通过平衡状态分析法进行比较分析。
(2).溶液的pH计算
酸可直接计算,碱可通过pOH转换成pH。
pH= -lg{c(H+)},pOH= -lg{c(OH-)},pKw=-lg{Kw}。
25℃时,pH+ pOH = 14
例题1:相同温度、相同物质的量浓度的四种溶液:①CH3COONa②NaHSO4③NaCl④C6H5—ONa,按pH由大到小的顺序排列,正确的是 ( )
A.④> ①> ③ > ②B.①> ④> ③ > ②
C.①> ②> ③ > ④D.④> ③> ① > ②
方法:溶液pH的大小由两种情况决定,一是电解质本身的电离,二是水的电离,而水的电离程度的大小又决定于盐类水解程度的大小。此类试题要求准确把握酸碱的相对强弱,充分依靠水解规律判析。
捷径:四种溶液可分成三组,②NaHSO4,电离显酸性,pH< 7;③NaCl为强酸强碱的正盐,不水解,溶液呈中性,pH=7;①④是强碱弱酸盐,水溶液均呈碱性,因CH3COOH 的酸性较C6H5OH强,故pH值应为 ④ >① ,以此得答案A。
总结:此类试题解答的一般步骤为:先分组,然后再对组内物质根据电离与水解程度进行判析。题中溶液除为盐溶液外,还可能为酸或碱。如等浓度的八种稀溶液:①Na2SO4②H2SO4③NaHSO4 ④NH4Cl⑤NaHCO3 ⑥NaCO3⑦NaOH ⑧Ba(OH)2,其pH由小到大的顺序为②③④①⑤⑥⑦⑧。
例题2:已知一种c(H+)=1×10-3mol·L-1的酸和一种c(OH—)= 1×10-3 mol·L-1碱溶液等体积混合后,溶液呈酸性。其原因可能是 ( )
A.浓的强酸和稀的强碱溶液反应 B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸弱碱盐
方法:酸碱中和后所得溶液的酸碱性主要有两方面因素制约,①盐的水解,②酸碱用量。解题时既要考虑酸碱的强弱,又要考虑酸碱用量的多少,两者缺一不可。
捷径:题中两溶液中的c(H+)=c(OH—),采用中和假想法,若是强酸强碱等体积混合,溶液一定呈中性。现溶液呈酸性,说明酸过量,且必须是弱酸。以此得答案B。
总结:中和反应后溶液的酸碱性由两方面决定。该题给出c(H+)=c(OH—),故应从酸碱用量考虑。如未理解题意,极易从盐的水解进行分析,故易错选C、D。
方法6 碳族方面试题的解题方法与技巧
6、碳族元素,作为元素化合物部分的重点内容,在近几年的高考试卷中,巳波及到新型无机非金属材料及锗、锡、铅三种元素的内容。
此类试题中的常规题,其解法有过量分析、守恒分析、方程式的合并分析等。
此类试题中的信息题,其解法有迁移类比、现象剖析、效用比较等。
经典题:
例题1:某二价金属碳酸盐和碳酸氢盐的混合物跟足量盐酸反应,消耗H+和产生CO2的物质的量之比为6:5,该混合物中碳酸盐和碳酸氢盐的物质的量之比为 ( )
A.1:1B.1:2C.1:3D.1:4
方法:利用假想法。将消耗H+和产生CO2的物质的量之比为6:5假想成消耗6molH+和产生5molCO2,然后再行分析求算。
捷径:设二价金属碳酸盐为RCO3,碳酸氢盐为R(HCO3)2,其物质的量分别为x和y。根据题意有:2x+ 2y = 6mol ,x+ 2y = 5mol 。解得x= 1mol ,y= 2mol 。混合物中碳酸盐和碳酸氢盐的物质的量之比为1:2,选B。
总结:部分考生在解题时,将混合物中碳酸盐和碳酸氢盐的物质的量之比理解成CO32-和HCO3-,而出现错选D选项的较多。
例题2:将1体积选项中的一种气体与10体积O2混和后,依次通过盛有足量浓NaOH溶液的洗气瓶和盛有足量灼热铜屑的管子(假设反应都进行完全,最后得到的尾气可以是 ( )
A.Cl2 B.CO C.CO2 D.N2
方法:找对气体来源,分析好气体去路。通过剖析来龙去脉求解。
捷径:A.Cl2与O2混合后,通过NaOH,Cl2全部被吸收,再通过热铜屑,O2被全部吸收,最后得不到尾气。
B.CO与O2混合后,通过NaOH溶液,都不能被吸收,再通过热铜屑,发生反应:2Cu+O2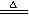
2CuO,CuO+CO 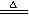
C.CO2与O2混合后,通过NaOH溶液,CO2被吸收,再通过热铜屑,O2被全部吸收,最后得不到尾气。
D.N2与O2混合后,通过NaOH溶液,都没有被吸收,再通过热铜屑,O2被吸收,最后得到尾气N2,所以D选项也为最后得到的尾气。
故本题答案为CD。
总结:本题的难点是对题意的理解。有学生误认为选项中的某种气体混入氧气后,再按题意依次反应后的尾气仍然是原选项中的气体。这是对题意的片面理解。正确的理解是,尾气可以是原选项,也可以是其他选项。对于这种设问尽管比较少见。但只要认真阅读,题中的设问是可以理解明白的。
策略7 氮族方面试题的解题方法与技巧
7、氮族元素,作为元素化合物部分的重点内容,在近几年的高考试卷中所占比例较大。其主要内容有氮族概念的分析与判断、氮的氧化物的分析与计算、硝酸及硝酸的性质分析与计算、磷及磷的化合物的分析与应用等。
此类试题中的常规题,其解法有过量分析、守恒分析、方程式的合并分析、工业生产中的用量比较等。
此类试题中的信息题,其解法有迁移类比、现象剖析、效用比较等。
经典题:
例题1:金属加工后的废切削液中含2%~3%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理废切削液,使NaNO2转化为无毒物质,该反应分两步进行:第一步:NaNO2+NH4Cl= NaCl+NH4NO2
第二步:NH4NO2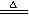
N2+2H2O
下列对第二步反应的叙述中正确的是
①NH4NO2是氧化剂 ②NH4NO2是还原剂 ③NH4NO2发生了分解反应 ④只有氮元素的化合价发生了变化 ⑤NH4NO2既是氧化剂又是还原剂 ( )
A.①③ B.①④ C.②③④ D.③④⑤
方法:根据方程式,对照叙述,从化合价、反应类型等方面综合分析。
捷径:NH4NO2==N2+2H2O这是分解反应,又是氧化还原反应,NO2—被NH4+还原生成N2,显然都是氮元素的化合价发生了变化。以此得答案为D。
总结:同一元素,如果一种显正价的微粒,另一种显负价的微粒,若它们发生氧化还原反应,则往往生成该元素的单质,如2H2S+SO2==3S+2H2O,NaH+H2O==NaOH+H2等。
例题2:某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是( )
A.NO2 B.NO C.N2O D.N2
方法:据题可知,2mol金属失去的电子给了1mol HNO3。可采取讨论试算的方法确定选项。
捷径:令金属为+1价,失2mol电子,N被还原后显+3价。
令金属为+2价,失4mol电子,N被还原后显+1价。令金属为+3价,失6mol电子,N被还原后显—1价。选项只有C符合。
总结:金属与HNO3反应后的价态,是该题求解的关键。部分考生因难以确定金属的价态,而造成无法获得结果。
策略8 氧族方面试题的解题方法与技巧
8、氧族元素包括了初中化学中氧气、水,高中化学中的臭氧、过氧化氢,硫及硫的化合物等。内容多,知识广,且有时还可能扩展到硒、碲、钋等元素。因此对其解题方法的掌握尤其重要。
此类试题中的常规题,其解法有过量分析、守恒分析等。
此类试题中的信息题,其解法有迁移类比、现象剖析、效用比较等。
由于浓硫酸与稀硫酸的性质不同,故在解题时,还必须注意,反应进行时浓度变化引起的反应变化。
经典题:
例题1:向50mL18mol/LH2SO4溶液中加入足量的铜片并加热。充分反应后,被还原的H2SO4的物质的量为 ( )
A.小于0.45moL B.等于0.45mol
C.在0.45mol和0.90mol D.大于0.90mol
方法:根据方程式,将参加反应的硫酸分成两部分,一部分为氧化作用,一部分为酸性作用,然后对其进行分析。但又要注意随着反应的进行,H2SO4的浓度越来越稀,稀硫酸不能与铜片反应,以此被还原的H2SO4的物质的量小于依据化学方程式计算的值。
捷径:浓H2SO4与足量的铜反应的化学方程式为:2H2SO4(浓)+Cu
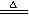
总结:该题存在着一个隐含信息,即随着反应的进行,溶液的浓度逐渐降低,反应自行停止。在解题时必须特别注意此类隐含信息。
例题2:为方便某些化学计算,有人将98%浓硫酸表示成下列形式,其中合理的是 ( )
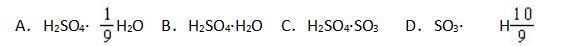
方法:质量假想法。
捷径:假设原98%硫酸的质量为100g,则98%浓H2SO4中有纯H2SO498g ,水2g。
则H2SO4与H2O的物质的量之比为
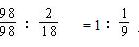
项是A项略作变形,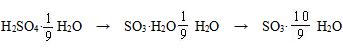
以此得答案为AD。
 加载中,请稍侯......
加载中,请稍侯......
精彩评论