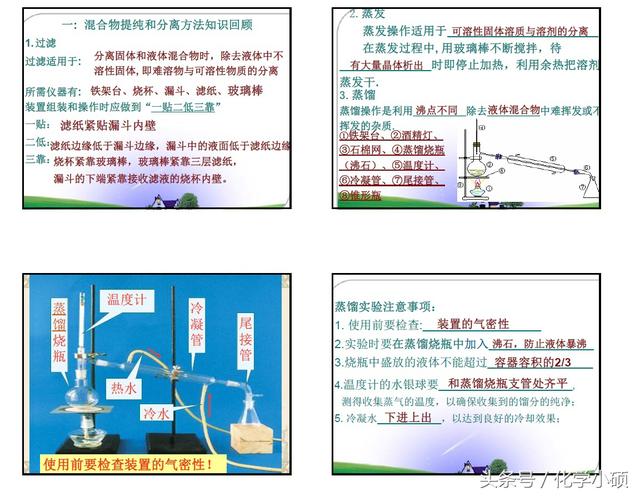
1.几种混合物的分离和提纯方法(C)
⑴ 过滤
原理: 除去液体中的不溶性固体
主要仪器: 漏斗,滤纸,玻璃棒,烧杯,铁架台(带铁圈)
操作要领及注意事项:
一贴: 将滤纸折叠好放入漏斗,加少量蒸馏水润湿,使滤纸紧贴漏斗内壁。
二低: 滤纸边缘应略低于漏斗边缘,滤液应略低于滤纸的边缘。
三靠: 向漏斗中倾倒液体时,烧杯的夹嘴应靠在玻璃棒上;
玻璃棒的底端应靠在三层滤纸一边;漏斗颈的末端应靠在烧杯上。
滤液仍浑浊的原因和处理方法.
⑵ 蒸发
原理:加热使溶剂挥发而得到溶质
主要仪器: 蒸发皿,玻璃棒,酒精灯,铁架台(带铁圈),石棉网,坩埚钳
操作要领及注意事项:
液体的量不得超过蒸发皿容量的2/3。
加热过程中,用玻璃棒不断搅拌液体,以免液体局部过热而使液体飞溅。
液体近干时,停止加热。
注意:何时开始搅拌? 何时转移蒸发皿?
⑶ 蒸馏
原理:利用加热将溶液中不同沸点的组分分离。
主要仪器: 蒸馏烧瓶,酒精灯,冷凝管,接受器,铁架台
操作要领及注意事项:
①蒸馏烧瓶保持干燥,加热需垫石棉网。
②在蒸馏烧瓶中放少量碎瓷片,防止液体暴沸。
③蒸馏烧瓶中所盛放液体占总体积的l/3到1/2,最多不超过2/3。
④温度计感温炮应与支管口相平。
⑤冷凝管中冷却水从下口进,从上口出。
⑥加热温度不能超过混合物中沸点最高物质的沸点,例如用分馏的方法进行石油的分馏。
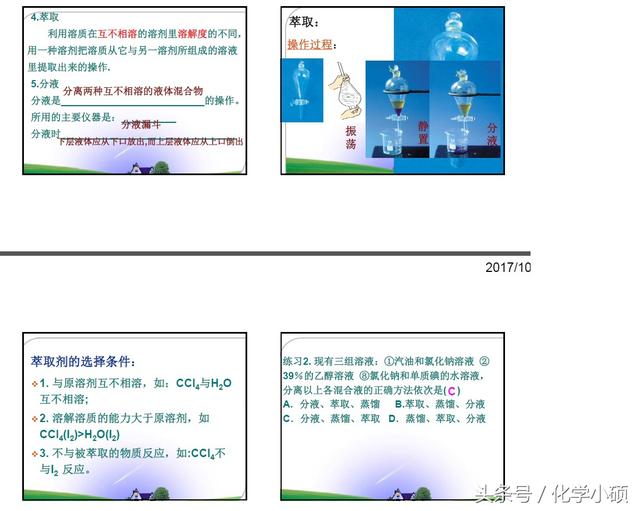
⑷ 萃取
原理: 利用同一溶质在两种互不相溶的溶剂中溶解度的差异来分离物质。
主要仪器: 分液漏斗
操作要领及注意事项: ① 检漏 ② 将要萃取的溶液和萃取溶剂依次从上口倒入分液
漏斗,其量不能超过漏斗容积的2/3,塞好塞子进行振荡。 ③ 两个溶剂互不相溶、存在密度差且不发生化学反应。 ④ 静置分层。 ⑤ 分液
分液:分离互不相溶的良种液体。
2、几种离子的检验(D)
⑴SO42- :向待测溶液中加入稀HNO3后,再加入BaCl2溶液,生成白色沉淀。
Ba2++ SO42-=== BaSO4↓
⑵Cl- :向待测溶液中加入稀HNO3 后,再加入AgNO3溶液,生成白色沉淀。
Ag++ Cl—==AgCl↓
⑶CO32- :向待测溶液中加入BaCl2溶液,生成白色沉淀,再加入稀盐酸或稀HNO3后,生成的气体使澄清石灰水变浑浊。
Ba2++ CO32-=== BaCO3↓ BaCO3 + 2HNO3 == Ba(NO3)2 + CO2↑+H2O
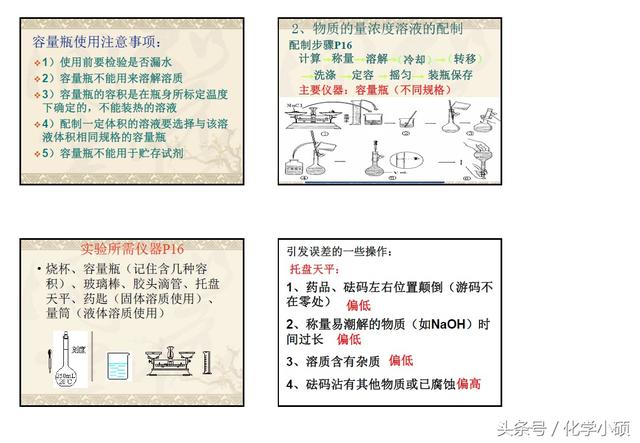
3.配制一定物质的量浓度的溶液(C)
⑴配制步骤
a、计算:算出固体溶质的质量或液体溶质的体积。
b、称量、量取:用托盘天平称取固体溶质质量,用量简量取所需液体溶质的体积。
c、溶解:将固体或液体溶质倒入烧杯中,加入适量的蒸馏水(约为所配溶液体积的1/6),用玻璃棒搅拌使之溶解,冷却到室温后,将溶液引流注入容量瓶里。
d、洗涤(转移):用适量蒸馏水将烧杯及玻璃棒洗涤2-3次,将洗涤液注入容量瓶。振荡,使溶液混合均匀。
e、定容:继续往容量瓶中小心地加水,直到液面接近刻度2-3m处,改用胶头滴管加水,使溶液凹面恰好与刻度相切。把容量瓶盖紧,再振荡摇匀。
f、装瓶
g、贴签

 加载中,请稍侯......
加载中,请稍侯......
精彩评论