要点一、化学反应速率
1、定义
化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。
化学反应正方向(从左向右)进行的反应速率称为正反应速率;化学反应逆方向(从右向左)进行的反应速率称为逆反应速率。
2、表示方法
若浓度用物质的量浓度(c)来表示,单位为mol/L;时间用t来表示,单位为秒(s)或分(min)或小时(h),则化学反应速率的数学表达式为:
v = △c/ t 单位:mol/(L·s) 或 mol/(L·min) 或 mol/(L·h)
要点诠释:
(1)化学反应速率是指某时间段内的平均反应速率,而不是某时刻的瞬时速率。
(2)化学反应速率可用来衡量化学反应进行的快慢,均为正值。
(3)因为纯固体、纯液体的浓度视为定值,所以该表达式只适用于有气态物质参加或溶液中的反应。
(4)同一反应选用不同物质浓度的改变量表示速率,数值可能不同,但表示的意义相同。因此,表示化学反应的速率时,必须说明是用反应物或生成物中的哪种物质做标准。
(5)对于同一反应,各物质化学反应速率之比=化学计量数之比=各物质转化浓度之比。
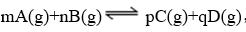
v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
要点二、影响化学反应速率的因素
1、内因(主要因素)
化学反应的速率是由反应物的性质决定的,即由反应物的分子结构或原子结构决定的。
2、外因(次要因素)
(1)浓度:其他条件不变时,增大反应物浓度,可以增大化学反应速率;减小反应物浓度,可以减小化学反应速率。
要点诠释:此规律只适用于气体反应或溶液中的反应,对于固体或纯液体反应物,一般情况下其浓度是常数,因此改变它们的量不会改变化学反应速率。
(2)压强:对于有气体参加的化学反应,若其他条件不变,增大压强,反应速率加快;减小压强,反应速率减慢。若参加反应的物质为固体或液体(溶液),由于压强的变化对它们的浓度几乎无影响,可以认为反应速率不变。对于有气体参加的可逆反应,增大压强,正反应速率、逆反应速率都增大;减小压强,正反应速率、逆反应速率都减小。
要点诠释:对于气体反应体系,有以下几种情况:
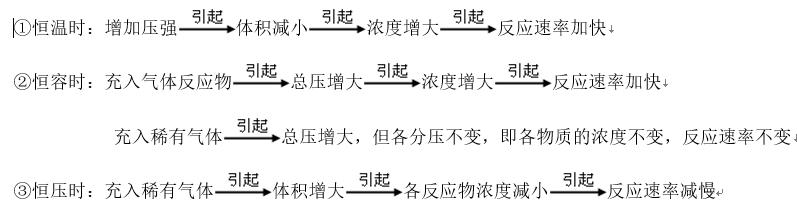
总之,压强改变,若引起浓度改变,则速率改变。
(3)温度:其他条件不变时,升高温度,可以增大反应速率,降低温度可以减慢反应速率。实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。温度对吸热反应、放热反应都适用。
(4)催化剂:催化剂能改变化学反应速率,但不能使本不发生的反应成为可能。可以提高反应速率的催化剂称为正催化剂,可以减缓反应速率的催化剂称为负催化剂。大多数的化工生产中,都有使用催化剂,而催化剂具有高度的选择性(专一性)。
要点诠释:
①没有特别说明,催化剂均指正催化剂。
②注意催化剂中毒的问题。
③催化剂要参与反应,但在整个反应结束后化学性质和质量没有发生变化。
(5)其他因素:光、超声波、反应物颗粒、扩散速度、溶剂等。
【典型例题】
类型一:化学反应速率
例1、反应4A(s)+3B(g)=2C(g)+D(s),经2min,B的浓度减少0.6mol/L。对此化学反应速率的正确表示是( )
A.用A表示的反应速率是0.4mol/(L·min)
B.分别用B、C表示反应的速率,其比值是3:2
C.在2min末的反应速率,用B表示是0.3mol/(L·min)
D.在这2min内B和C两物质浓度都逐渐减小
【答案】B
【解析】A为固体,一般不用固体表示反应速率,因为固体的浓度一般视为常数,所以A项错误;同一反应用不同物质表示的化学反应速率,其比值与化学方程式中化学计量数成正比,故B正确;v(B)=0.3mol/(L·min)为平均值,并非2min末的反应速率,所以C项错误;B为反应物,C为生成物,两者不可能同时减小,故D项错误。
【总结升华】用不同物质表示同一时间段内的同一化学反应的速率时,其速率之比等于化学方程式中化学计量数之比。
举一反三:
【变式1】下面有关化学反应速率的说法中正确的是( )
A.对任何化学反应来说,反应速率越大,反应现象就越明显
B.化学反应速率通常用单位时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加来表示
C.若某化学反应的反应速率为0.5mol/(L·s)就是指在该时间内反应物和生成物的浓度变化都为0.5mol/(L·s)
D.化学反应速率是用来衡量化学反应进行快慢的尺度
【答案】BD
【解析】对于无明显现象的化学反应来说,无法通过现象体现反应速率的大小,则A选项错误;同一反应选用不同物质浓度的改变量表示速率,数值可能不同,表示化学反应的速率时,必须说明是用反应物或生成物中的哪种物质做标准,则C选项也不正确。
类型二:化学反应速率的计算

类型三:影响化学反应速率的因素
例3、一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率且不影响生成H2的总量,可向盐酸中加入定量的()
A.Na2CO3粉末
B.K2SO4溶液
C.NH4Cl固体
D.水
【答案】BD
【解析】此反应的离子方程式为Fe+2H+===Fe2++H2↑,因为铁是固体,要在一定温度下减缓反应速率,应该采用降低浓度的方法。降低H+浓度的方法有两种:一种是加入一种能与H+反应的物质,如加入碳酸钠(固体),由于碳酸钠与H+反应生成二氧化碳气体,使H+浓度降低,反应速率减慢,但由于消耗H+,从而使产生H2的总量减少,不符合题意;另一种方法是加水稀释,既可以降低H+浓度,使反应速率减慢,又不改变H+的总量,使产生氢气的总量保持不变;加入硫酸钾溶液与加入水的作用是相同的。
【总结升华】本题考查了影响化学反应速率的外界因素。影响化学反应速率的主要因素是反应物的性质(内因),对确定的化学反应来说,浓度、温度、压强、催化剂、反应物接触面积的大小也会对反应速率产生影响。解答此类题目时,应结合外界条件对反应速率的影响、各因素的适用范围及注意事项等,对具体问题作出分析和解答。
举一反三:
【变式1】下列措施肯定能使化学反应速率增大的是()
A.增大反应物的量
B.增加压强
C.升高温度
D.使用催化剂
【答案】C
【解析】反应物若是固体或纯液体,增加反应物的量或改变压强不影响反应速率;温度影响反应速率,与反应物的状态无关;催化剂有正负之分。
【变式2】对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是:①升高温度;②改用100mL 3mol/L盐酸;③多用300mL 1mol/L盐酸;④用等量锌粉代替锌粒( )
A.①③④ B.①②④ C.②③④ D.①②③
【答案】B
 加载中,请稍侯......
加载中,请稍侯......
精彩评论