一套完整的化学实验装置包括:
气体发生→除杂质→干燥→主体实验→尾气处理。
在解答问题时一定要了解实验的目的,明确实验中发生的反应以及发生反应所需的条件,还要知道实验中提供的仪器的用途。
一.考查气体发生装置根据反应
物的状态和反应条件选择发生装置,中学阶段常见的发生装置的特点有:固液常温型(如H2、CO2、H2S、NO2、C2H2、SO2、NO)、固固加热型(如O2、NH3)、固液加热或液液加热型(如Cl2、C2H4)。有的实验为了排除空气对实验的干扰,实验前还要对装置进行处。
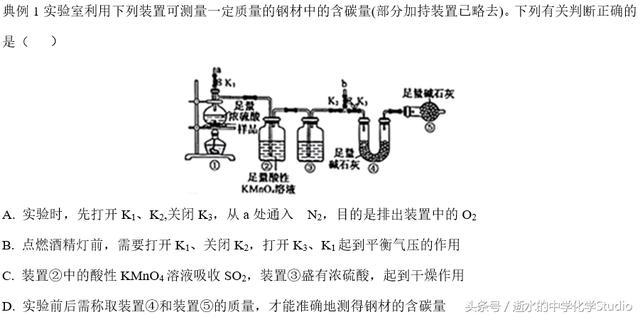
解析:样品与浓硫酸会反应生成二氧化硫、二氧化碳和水。实验时为防止空气中CO2干扰,应先打开K1、K2,关闭K3,从a处通入N2,排出装置中的CO2,A错误;点燃酒精灯前,需要关闭K1、K2,打开K3,实验中K1无平衡气压的作用, B错误;高锰酸钾溶液具有强氧化
性,可以吸收二氧化硫,装置③中的浓硫酸干燥二氧化碳,防止
水蒸气对二氧化碳吸收的影响,C正确;装置⑤干燥管中的碱石灰是吸收空气中的水蒸气和二氧化碳,实验前后只需称取装置④的质量,就能准确地测得钢材的含碳量,D错误。
二.考查气体的除杂净化
制备物质时,为了得到纯净的生成物,防止副反应的发生,要对制取的气体进行净化除杂干燥处
理。实验室制取的气体中,混有的杂质及除杂、干燥方法如下表:
气体 | CO2 | Cl2 | NO | C2H2 | C2H4 |
杂质 | HCl | HCl | NO2 | H2S等 | C2H5OH、CO2、SO2 |
除杂试剂 | 饱和NaHCO3 | 饱和食盐水 | 水 | CuSO4溶液 | NaOH溶液 |
干燥试剂 | 浓H2SO4 | 浓H2SO4 | 浓H2SO4 |
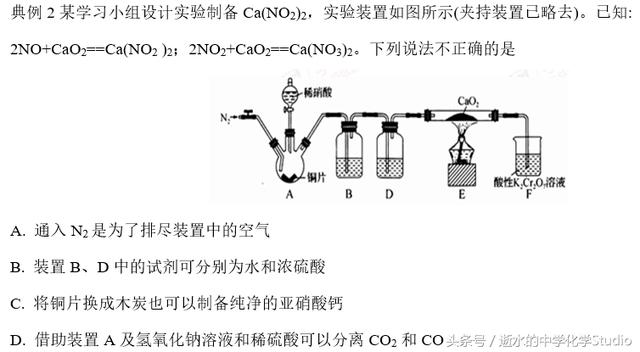
解析:装置内的空气会将NO氧化为NO2,影响产物,所以通入N2排尽装置中的空气, A正确;硝酸具有挥发性,A中生成的NO气体中含有少量HNO3蒸气,可用装置B中的水除去,为防止CaO2与水反应,用装置D中的浓硫酸对NO气体进行干燥,B正确;将铜片换成木炭,木炭与稀硝酸不反应,得不到NO,C错误;装置A中盛氢氧化钠溶液,通过进气管通入CO2 和CO的混合气体,CO2 被NaOH吸收后生成Na2CO3,在出气管口可收集到CO,然后将分液漏斗中的稀硫酸滴入A中,与生成的Na2CO3反应再
释放出CO2,达到分离的目的,D正确。
三.考查主体实验及尾气处理
化学实验是有目的的,这个目的就是要完成主体实验。解题时要注意主体反应的原理、反应的本质、反应的现象以及干扰实验的因素、可能发生的副反应,最后还要对尾气进行处理,防止污染空气。
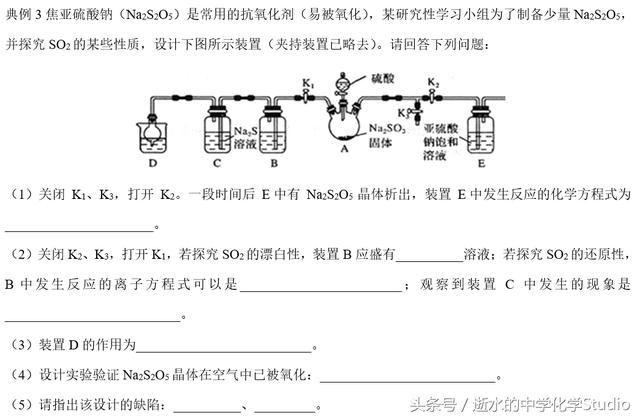
解析:(1)装置E中发生反应是该实验的主体反应,用SO2和Na2SO3制备焦亚硫酸钠(Na2S2O5),化学方程式为SO2+Na2SO3=Na2S2O5;(2)关闭K2、K3,打开K1,若探究SO2的漂白性,装置B应盛有品红溶液溶液;若探究SO2的还原性,B中发生反应的离子方程式可以是:SO2+Br2+2H2O=2Br-+SO42-+4H+或SO2+Cl2+2H2O=2Cl-+SO42-+4H+或2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+或2Fe3++SO2+2H2O=2F
e2++SO42-+4H+;C中发生的反应为:SO2+2H2S=3S↓+2H2O,观察到的现象是有淡黄色沉淀生成;(3)装置D的作用为除去多余的SO2,防止污染空气;(4)要设计实验验证Na2S2O5晶体在空气中已被氧化:首先要明确Na2S2O5晶体在空气中易被氧化为Na2SO4,验证Na2S2O5晶体在空气中已被氧化,就是检验SO42-,方法:取少量Na2S2O5晶体于试管中,加适量水溶解,再滴加足量盐酸,振荡,再滴入BaCl2溶液,有白色沉淀生成。(5)该设计的缺陷:AB之间、AE之间没有防倒吸装置或没有排除装置内空气,防止Na2S2O5被氧化(没有防止Na2S2O5被氧化的措施);装置E后也应有SO2的尾气吸收装置,防止污染空气。
解答实验方案的设计和评价问题时,首先要掌握化学实验的基本流程,即发生装置、除杂净化装置、主体反应装置、尾气处理装置。同时还要了解实验目的,达到此实验目的涉及了哪些化学反应,发生这些化学反应需要什么样的条件,针对主体实验有哪些因素干扰,排除这些干扰因素应采取什么措施,最后还要注意尾气处理。
 加载中,请稍侯......
加载中,请稍侯......
精彩评论