化学反应中的能量变化,新教材作为一主线编入其中。尽管过去相关内容在教材中的篇幅不多,但近十年的高考主要涉及下列内容:
(1)书写热化学方程式或判断热化学方程式的正误;
(2)有关反应热的计算;
(3)比较反应热的大小。
最近又出现反应热与能源结合起来进行考查。由于能源问题已成为社会热点,有关能源的试题也将成为今后命题的重点。《考试说明》化学反应与能量增加了,了解燃烧热和中和热等概念;这要引起足够的重视。预计考查反应热的内容将不断拓宽,难度有所提高,题型也会有新的变化。能量及其转化是化学、物理、生物学科中的一个重要内容,是理科综合试题的知识载体之一,因此有关能量的学科间的综合将会成为今后理科综合命题的热点。

【例1】下列说法正确的是 ( )
A.需要加热才能发生的反应一定是吸热反应
B.化学反应中的能量变化都表现为热量变化
C.任何放热反应在常温下一定能发生反应
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热 .
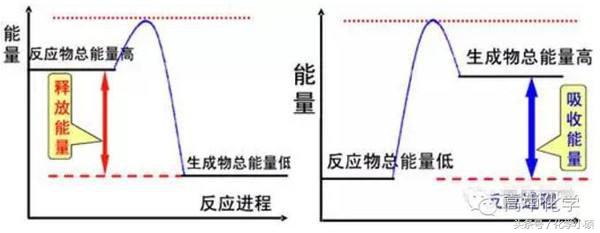
思维启迪:化学反应的能量变化主要表现为放热或吸热,有的以光能的形式表现。反应是放热还是吸热主要取决于反应物和生成物的总能量的相对大小。放热反应和吸热反应在一定条件下都能发生,反应开始时需加热的反应可能是吸热反应也可能是放热反应。
正确解答:D
例2 已知破坏各1 mol N三N键、H—H键和N—H键分别需吸收的能量为946 kJ、436 kJ、391kJ。计算1 mol N2(g)和3 mol H2(g)完全转化为NH3(g)的反应热的理论值。
思维启迪:N2(g)与H2(g)反应的热化学方程式为N2(g)+3H2(g)=2NH3(g),使1mol的N三N键断裂吸收946 kJ的能量,使3 molH—H键断裂共需吸收436 kJ·mol-1 *3 mol=1308 kJ的能量,因此使1 mol N2(g)和3 mol H2(g)反应物的化学键断裂共需吸收的能量为946kJ+1308 kJ=2254 kJ。而2 mol NH3(g)中含6 mol N—H键,形成6 mol N—H键时放出能量为391 kJ·mol-1 *6 mol=2346 kJ。因此反应热应等于生成物分子形成时所释放的总能量(2346 kJ·mol-1)与反应物分子断裂时所吸收的总能量(2254 kJ·mol-1)的差,即放出了92 kJ·mol-1的能量,也即△H=一92 kJ·mol-1。
【例3】 如下图是验证水生绿色植物进行光合作用(6CO2+6H2O →C6H12O6(葡萄糖)+6O2)的实验装置图,锥形瓶中放入天然水和新鲜水草,瓶口用带有导气管的橡皮塞塞紧并连接在盛有红色液体的U形玻璃管上。经光照一段时间后,U形管左侧管内液面的高度变化和锥形瓶内溶液的pH值变化量分别是 ( )
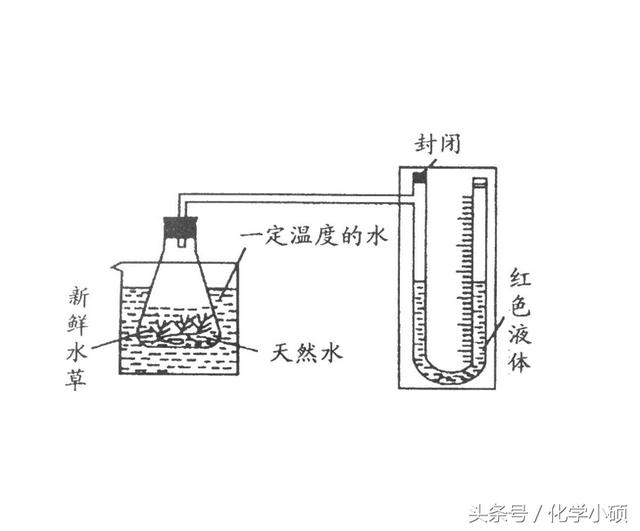
A.升高,升高 B.升高,降低
c.降低,升高 D.降低,降低
思维启迪:这是一道化学、生物、物理的相关知识的综合题。小草在进行光合作用时,发生反应6C02+6H20→C6H1206+602。在反应中消耗了水中C02,同时产生等量02,因此溶液的pH值升高。由于光照作用下气体温度升高,使锥形瓶内压强增大,造成左侧管液面下降。
正确解答:C
 加载中,请稍侯......
加载中,请稍侯......
精彩评论