一、氮气
1. 氮元素的存在
既有游离态又有化合态。它以双原子分子(N2)存在于大气中,约占空气总体积的78%或总质量的75%。氮是生命物质中的重要组成元素,是构成蛋白质和核酸不可缺少的元素。是农作物生长所必需的元素.充足的氮肥使植物枝叶茂盛.叶片增大,从而提高农作物的产量和质量。
2. 气的结构和性质
(1)物理性质
纯净的氮气是一种无色、无味、密度比空气稍小的气体,熔点为-209.86℃。沸点为-195.8℃,难溶于水。(思考N2的收集方法?)
(2)结构:电子式为:______________ 结构式为___________,氮氮叁键的键能高达946kJ·mol-1,键能大,分子结构稳定,化学性质不活泼。
(3)化学性质
常温下,N2的化学性质很不活泼,可代替稀有气体做保护气,但在高温、放电、点燃等条件下,N2能与H2、O2等发生化学反应。
①N2+3H2

2NH3(可逆反应)
是工业上合成氨的反应原理。
②与O2反应:
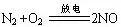
③与Mg反应:
N2 +3 Mg
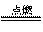
Mg3N2;Mg3N2 + 6H2O=3Mg(OH)2↓+ 2NH3↑
3. 氮气的用途与工业制法
(1)氮气的用途:
合成氨;制硝酸;用作保护气;保护农副产品;液氮可作冷冻剂。
(2)氮气的工业制法
工业上从液态空气中,利用液态氮的沸点比液态氧的沸点低加以分离而制得氮气。
4. 氮的固定
将空气中游离的氮气转变为氮的化合物的方法,统称为氮的固定。氮的固定有三种途径:
(1)生物固氮:豆科作物根瘤菌将N2转化为化合态氮。
(2)自然固氮:天空中打雷闪电时,N2转化为NO。
(3)工业固氮:在一定的条件下,N2和H2人工合成氨。
二、氮的氧化物
(1)物理性质
NO:无色、无味的气体,难溶于水,有毒。
NO2:红棕色、有刺激性气味的气体,有毒。
(2)化学性质
NO:不与水反应,易被氧气氧化为NO2。
2NO+ O2=== 2NO2
NO2:①易与水反应生成硝酸和NO,在工业上利用这一反应制取硝酸。
3NO2+ H2O=2HNO3+NO
②有较强的氧化性,可使湿润的淀粉碘化钾试纸变蓝。
三、氨
1. 结构和性质
(1)物理性质
氨是无色有刺激性气味的气体,密度比空气小,极易液化.极易溶于水,常温常压下,1体积水能溶解约700体积的氨.
(2)分子结构
化学式NH3;电子式 ___________;结构式:__________________
氨分子为三角锥形
(3)化学性质
①与水反应
氨溶于水的水溶液称为氨水,其中大部分NH3与水结合成一水合氨(NH3·H2O),但氨水的溶质仍然为NH3.一水合氨可以部分电离成NH4+和 OH-,故氨水显弱碱性,能使酚酞试液变红。NH3·H2O受热又容易分解为NH3和H2O。氨水的密度小于1g·mL-1,且溶质的质量分数越大,溶液的密度越小。NH3是中学化学中唯一能使湿润的红色石蕊试纸变蓝的气体,常用此性质检验NH3的存在。
NH3 +H2O

NH3·H2O

NH4+ + OH-
②与酸反应
NH3 +HCl=NH4Cl(产生白烟,可用于检验NH3 )
NH3 +CO2+ H2O =NH4HCO3(俗称碳氨)
2NH3 +H2SO4 =(NH4)2SO4;NH3 + HNO3 =NH4NO3
③具有还原性
4NH3 + 5O2

6 H2O + 4NO
(氨的催化氧化,是工业上制硝酸的基础,也是工业上制NO的方法)
2 NH3 +3Cl2=N2 + 6HCl;8 NH3 +3Cl2=N2 + 6NH4Cl
2 NH3 +3CuO

N2 +3Cu+3H2O
2. 氨的用途与保存
(1)用途:
①氨是氮肥工业及制造硝酸、铵盐、纯碱等的重要原料。
②氨也是有机合成工业的常用原料(如制尿素合成纤维、染料等)。
③氨还可用作制冷剂。
(2)保存:
氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶内。
3. 氨的实验室制法
(1)实验原理:用铵盐与碱共热。
2NH4Cl+ Ca(OH)2

CaCl2+ 2NH3↑+2H2O
(2)装置:(见下图)
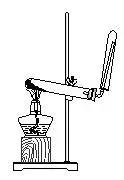
(3)收集:向下排空气法。
(4)检验:
①用红色的石蕊试纸检验是否变蓝。
②用粘有浓盐酸的玻璃棒检验,产生白烟。
(5)干燥:用碱石灰干燥。
注意:也可用浓氨水与强碱混合;或向浓氨水中加生石灰:
2NH3·H2O+CaO=Ca(OH)2+2NH3↑+ H2O
四、铵盐
1. 定义
由铵根离子(NH4+)和酸根离子构成的化合物叫做铵盐。
2. 铵盐的性质
铵盐都是晶体,均溶于水。
(1)铵盐受热分解
NH4Cl

NH3↑+HCl; NH4HCO3

NH3↑+ H2O+ CO2↑
(2)铵盐与碱的反应
固态:NH4NO3+ NaOH

NaNO3+NH3↑+ H2O
(NH4)2SO4+ 2NaOH

Na2SO4+2NH3↑+2H2O
液态:NH4+ + OH-

NH3↑+ H2O
(3)NH4+的检验
向含有NH4+的溶液或晶体中滴加浓NaOH溶液,加热时有刺激性气味的气体生成且气体能使湿润的红色石蕊试纸变蓝,则证明了溶液或晶体中NH4+的存在。
五、硝酸
1. 硝酸的物理性质
纯硝酸是无色易挥发、有刺激性气味的液体,能与水以任意比混溶。
98%以上的浓硝酸在空气中由于挥发出HNO3而产生“发烟”现象,通常叫做发烟硝酸。
2. 硝酸的化学性质
(1)硝酸的不稳定性
硝酸不稳定,很容易分解、硝酸越浓,就越容易分解。
4HNO3(浓)

2H2O+ 4NO2↑+O2↑
浓硝酸呈黄色,就是由于硝酸分解产生的NO2溶于硝酸的缘故。
(2)硝酸的强氧化性
①氧化金属
硝酸是一种强氧化剂,几乎能与所有的金属(Pt.Au除外)发生氧化还原反应,但常温下,铁、铝在浓硝酸中发生钝化。
Cu + 4HNO3(浓)= Cu(NO3)2 +2NO2↑+ 2H2O
3 Cu + 8HNO3(稀)= 3Cu(NO3)2 +2NO↑+ 4H2O
Ag+ 2HNO3(浓)= AgNO3 +NO2↑+ H2O
3Ag+ 4HNO3(稀)= 3AgNO3 +NO↑+ 2H2O
②氧化非金属
硝酸还能与许多非金属及某些有机物发生氧化还原反应。
4HNO3(浓)+ C

4NO2↑+ 2H20 +CO2↑
6HNO3(浓)+ S

6NO2↑+ 2H20 +H 2SO4↑

 加载中,请稍侯......
加载中,请稍侯......
精彩评论