一、过氧化物的性质
1、过氧化钠的结构特点:过氧化钠是离子化合物,阴离子是过氧根(O22-),其中氧元素的化合价为-1价,因此过氧化钠既有氧化性又有还原性,而以氧化性为主,是强氧化剂。
2、过氧化钠不是碱性氧化物:碱性氧化物的定义是:当和酸反应只生成盐和水的氧化物。而过氧化钠与酸反应除了生成盐和水以外,还有氧气生成。例如:
2Na2O2+4HCl=4NaCl+2H2O+O2↑
3、过氧化钠的氧化性和还原性:过氧化钠中,杨元素的化合价为-1价,当作氧化剂时,氧元素降至-2价;当作还原剂时,氧元素的化合价为0价。
⑴作氧化剂: Na2O2+SO2=Na2SO4
在碱性条件下可以氧化一些中强氧化性物质。
例:Na2O2+MnO2=Na2MnO4
⑵作还原剂:即遇到强氧化剂时,Na2O2被氧化。
⑶歧化反应
a、与水反应
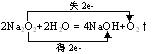
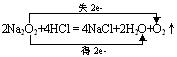
b、与酸反应
c、与CO2反应 2Na2O2+2CO2=2NaCO3+O2↑
这类反应的实质是过氧化钠先与水作用生成过氧化氢,其后过氧化氢再分解产生氧气。
Na2O2+2H2O=2NaOH+H2O2
Na2O2+H2SO4=Na2SO4+H2O2
2H2O2=2H2O+O2↑
4、过氧化物的漂白作用与氯气漂白作用类似,是不可逆过程,表现了过氧化钠的强氧化性。
5、Na2O与Na2O2的性质比较:
氧化物 | Na2O | Na2O2 |
结构 | 离子化合物,氧元素化合价为-2价 | 离子化合物,氧元素化合价为-1价 |
类别 | 碱性氧化物 | 过氧化物 |
颜色状态 | 白色固体 | 淡黄色固体 |
与水反应 | Na2O+2H2O=2NaOH | 2Na2O2+2H2O=4NaOH+O2↑ |
与CO2反应 | Na2O+CO2=Na2CO3 | 2Na2O2+2CO2=2Na2CO3+O2↑ |
与酸反应 | Na2O+2HCl=2NaCl+H2O | 2Na2O2+4HCl=4NaCl+2H2O+O2↑ |
用途 | 制NaOH | 用于潜水航空的制备剂,做漂白剂(漂白织物羽毛等) |

二、NaCO3和NaHCO3的性质
Na2CO3 | NaHCO3 | |
俗称 | 纯碱、苏打 | 小苏打 |
外观 | 白色粉末,NaCO3·10H2O为晶体,易风化 | 细小的白色晶体 |
与强酸反应 | CO32-+2H+=H2O+CO2↑ | HCO3-+H+=H2O+CO2↑ |
与强碱反应 | 与碱一般不反应,但可生成沉淀的碱 Ca2++CO32-=CaCO3↓ | HCO3-+OH-=H2O+CO32- |
热稳定性 | 稳定 | 受热分解:2NaHCO3=(△)Na2CO3+H2O+CO2 |
用途 | 制肥皂、玻璃、造纸、纺织 | 制发酵粉、治疗胃酸过多 |
相互转化 |
| |
2、Na2CO3和NaHCO3在水中溶解性及电离
Na2CO3和NaHCO3都溶于水,但NaHCO3在水中的溶解度较小,这与其它碳酸盐在水中的溶解性规律不同。盐类在水中溶解性的一般规律是酸式盐的溶解性大于正盐的溶解性。候德榜制碱法正是利用NaHCO3在水中溶解度小的性质,向饱和的氯化钠和氨的混合液中通路过量CO2,析出NaHCO3。
在水中的电离:NaCO3=2Na++CO32-
NaHCO3=Na++HCO3-
3、NaCO3和NaHCO3与酸反应:NaHCO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
NaHCO3与酸反应剧烈得多,消耗的酸少(泡沫灭火器中盛有NaHCO3)CO2气体逸出;Na2CO3溶液中开始无气体逸出,加酸至一定量以后才有CO2气体产生。由此可鉴别Na2CO3溶液和NaHCO3溶液。
将Na2CO3溶液或NaHCO3溶液加入酸溶液中时,有预算是过量的,都会立即产生CO2气体逸出。
4、Na2CO3和NaHCO3与碱反应。
Na2CO3只能与某些可溶性碱[如Ca(OH)2]发生复分解反应。而NaHCO3中由于有一个H原子,HCO3-可电离出一个H+,可与所有的可溶性碱反应,
某反应的离子方程式为:HCO3-+OH-=H2O+CO32-
5、NaCO3和NaHCO3的鉴别
根据热稳定性进行鉴别:分别加热固体NaCO3和NaHCO3,有气体放出的是NaHCO3。鉴别其溶液的方法是:将稀酸逐滴加入Na2CO3溶液和NaHCO3中,一开始就有气体放出的是NaHCO3溶液;也可加入少量BaCl2溶液或CaCl2溶液,产生白色沉淀者为Na2CO3溶液。
6、Na2CO3和NaHCO3的提纯。
Na2CO3中含有NaHCO3,加热分解NaHCO3成Na2CO3;NaHCO3中含有 Na2CO3时通入足量的CO2气体,使NaHCO3转化成NaHCO3.

三、碱金属元素
1、碱金属所包含的元素
碱金属包含Li、Na、K、Rb、Cs、Fr等六种元素。由于Fr是人工放射性;不在中学中学习。
2、碱金属元素的原子结构
相似性:碱金属元素的原子最外层只有一个电子,次外层为8个电子,(其中Li原子次外层只有2个电子)。所以在化学反应中,碱金属元素的原子总是失去最外层的一个电子而显+1价。
递交性:Li、Na、Rb、Cs等碱金属元素的原子核外电子层数是逐渐增减增多的,原子半径也逐渐易失去,元素的金属活动性逐渐增强。
3、碱金属的物理性质及其变化规律
(1)颜色:银白色金属(Cs略带金色光泽);
(2)硬度:随Li、Na、K、Rb、Cs金属的硬度逐渐减小。这是由于原子的电子层数逐渐增多,原子半径逐渐增大,原子半径逐渐增大,原子之间的作用力逐渐减弱所以导致金属的硬度小,用小刀可切开。
(3)碱金属的熔点低。熔点最高的锂为180.5℃,铯的熔点是28.4℃。随着原子序数的增加,单质的熔点逐渐降低。
(4)碱金属的密度小。Li、Na、K的密度小于水的密度,且锂的密度小于煤油的密度。按道理,随着原子序数的增大,碱金属的密度应逐渐增大。但钾的密度却小于钠的密度,出现“反常”现象。这是由于金属的密度取决于两个方面的作用,一方面是相对原子质量的作用,另一方面是原子体积的作用。从钠到钾的相对原子质量增大所起的作用小于原子体积增大的作用,所以钾的密度反而比钠的密度小。
4、碱金属的化学性质
碱金属与钠一样都是活泼的金属,其性质与钠的性质类似。但由于碱金属原子结构相互之间又有不同,其金属性活泼的程度有所差异,其化合物性质也有差异。
(1)与水反应
相似性:碱金属单质都能与水反应,生成碱和氢气。
2R+2H2O=2ROH+H2↑(R代表碱金属原子)
递交性:随着原子序数的增大,金属与水反应的剧烈程度增大,其生成物的碱性增强。例如:Na于冷水反应放出热量将钠溶成小球,而K与冷水反应时K球发红,氢气燃烧,并有轻微爆炸。LiOH是中强碱,CsOH是最强碱。
(2)与非金属反应
相似性:碱金属的单质可占大多数非金属单质反应,生成物都是含R+阳离子的离子化合物。
差异性:碱金属与氧气反应时,除Li和常温下缓慢氧化的Na能生成正常的氧化物(R2O)外,其余的碱金属氧化物是复杂氧化物。
4Li+O2=2Li2O
4Na+O2=(缓慢氧化)2Na2O
2Na+O2=(燃烧)Na2O2
K+O2=KO2[超氧化钾,O的化合价为(-1/2价)]
碱金属与氧化物反应:
碱金属单质都有较强的还原性,可还原金属氧化物及不活泼的金属氧化物。工业常用金属Na还原稀有金属的化合物制备稀有金属。
(4)与盐溶液反应
碱金属与盐的水溶液反应,首先是金属与水反应生成碱和氧气。碱再与盐反应。特别注意:碱金属单质都不能从盐溶液中置换出较不活泼金属。
5、焰色反应
(1)概念:焰色反应是指某些金属化合物在火焰中灼烧时,火焰呈特殊的颜色。
(2)几种金属及其离子的焰色
Li(或Li+)紫红 K(或K+)紫色(隔蓝色钴玻璃观看) Na(或Na+)黄色
Rb(或Rb+)紫色 Ca(或Ca2+)砖红色 Ba(或Ba2+)黄绿色
Sr(Sr2+)洋红色
(3)焰色反应是物理变化。焰色是因为金属原子或离子外围电子发生跃迁,然后回落到原位时放出的能量。由于电子回落过程放出能量的频率不同而产生不同的光。所以焰色反应中没有新物质生成。
(4)焰色反应实验的注意事项:
a、火焰最好是无色的或浅色的,以免干扰离子的焰色。
b、每次实验前要将铂丝在盐酸洗净关在灯焰上烧至火焰无色(在酒精灯焰上烧至不改变焰色)
c、观察钾原子的紫色火焰应隔着蓝色钴玻璃片,以滤去对紫色光有遮盖的作用黄光。
6、碱金属的实验室保存方法
碱金属都是活泼金属,极易与空气中的水、氧气等反应,保存时应隔绝空气和水,金属钠、金属钾保存在干燥的煤油中,而金属里的密度小,只能保存于液态石蜡中。

NaOH
(1)氢氧化钠的物理性质:白色固体,有强吸水性、易潮解,可作中性或碱性气体的干燥剂,如干燥NH3、H2、O2、CO等,一般将氢氧化钠和生石灰按一定比例混合制碱石灰.
(2)化学性质:强碱、具有碱的通性.用NaOH溶液吸收SO2时:
2NaOH+SO2 = Na2SO3+H2O(SO2适量)
NaOH+SO2 = NaHSO3(SO2过量)
2NaOH+CO2 = Na2CO3+H2O(CO2适量)
NaOH+CO2 = NaHCO3(CO2 过量)
(3)制法:
工业制法:2NaCl+2H2O

制取少量时:Na2CO3+Ca(OH)2 = CaCO3↓+2NaOHv
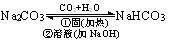
 加载中,请稍侯......
加载中,请稍侯......
精彩评论