黑龙江省大庆铁人中学高二上学期开学考试化学试卷(含答案)(文件编号:21021720)
关注微信公众号:cc518xxzl 可免费领取本资料word完整版!
简介:
大庆铁人中学高二年级暑假学习效果验收考试
化学试题
试题说明:
1.本试题共24小题,满分100分,答题时间90分钟。
2.请将答案填写在答题卡上,考试结束只交答题卡。
3.可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 S 32
Cl 35.5 Cu 64
一、单选题(本大题共有20小题,每题3分,共60分)
1.某同学为检测溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )
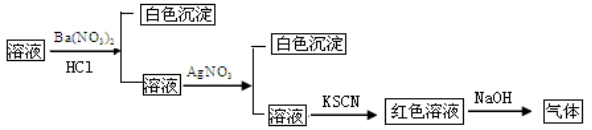
A.原溶液中一定含有SO42—离子
B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl—离子
D.原溶液中一定含有Fe3+离子
2.下列说法正确的是( )
A.硫粉在过量的纯氧中燃烧可以生成SO3
B.可以用澄清石灰水鉴别SO2和CO2
C.SO2能使酸性KMnO4水溶液褪色,是因为SO2有漂白性
D.SO2通入到紫色石蕊试液中,溶液只变红不褪色
3.下列各组离子,在溶液中可以大量共存的是( )
A.Na+、S2-、K+、SO32-
B.Na+、Fe2+、H+、NO3-
C.Al3+、K+、Cl-、HCO3-
D.Na+、K+、ClO-、SO32-
4.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与2.24LO2(标准状况)混合后通入水中,所有气体完全被水吸收,所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.50mL B.60mL
C.80mL D.100mL
5.下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )
物质 选项 | a | b |
|
A. | H2S | S | SO2 |
B. | HNO3 | NO | NO2 |
C. | Si | SiO2 | Na2SiO3 |
D. | Fe | FeCl2 | FeCl3 |
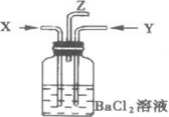
A.集气瓶中产生的沉淀是碳酸钡
B.Z导管出来的气体中含有二氧化碳
C.集气瓶中产生的沉淀是亚硫酸钡
D.集气瓶中溶液无明显变化
7.一些科学家预言存在稳定的超重元素,如:Z=114,N=184的原子,它位于元素周期表的第七周期,第ⅣA族,下列说法正确的是( )
A.第七周期有50种核素
B.该原子的质量数为184
C.该元素的相对原子质量为298
D.该原子核外有114个电子
8.1999年曾报道合成和分离了含高能量的N5+的化合物N5AsF6,下列叙述错误的是( )
A.N5+具有34个电子
B.N5+中氮-氮之间是以离子键结合
C.化合物N5AsF6中As的化合价为+5
D.化合物N5AsF6中F的化合价为-1
9.氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是( )
A.1mol的1H35Cl分子所含中子数约为18×6.02×1023
B.35Cl原子所含质子数为18
C.7g35Cl2气体的体积约为2.24L
D.35Cl2气体的摩尔质量为70g
10.短周期的三种元素X、Y、Z,已知X元素的原子最外只有一个电子,Y元素的原子M层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L层上的电子数比Y元素原子的L层上的电子数少2个,则这三种元素所组成的化合物的化学式不可能的是( )
A.XYZ3 B.X2YZ4
C.X3YZ4 D.X4Y2Z7
11.已知反应:CH3CHO(g)+aO2(g)=X+bH2O(l) ΔH,X为下列何种物质时ΔH最小( )
A.CH3COOH(l) B.CH3COOH(g)
C.CO(g) D.CO2(g)
12.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1
已知:碳的燃烧热ΔH1=a kJ·mol-1
S(s)+2K(s)===K2S(s) ΔH2=b kJ·mol-1
2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·mol-1,则x为( )
A.a+b-c B.c-3a-b
C.3a+b-c D.c-a-b
13.已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是( )
A.H2(g)的燃烧热为-571.6kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)燃烧放出的热量多
C.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+H2O(l) ΔH=-57.3kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9kJ·mol-1
14.下列关于反应能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1,E生成物>E反应物
B.4CuO(s)=2Cu2O(s)+O2(g)在室温下不能自发进行,说明该反应ΔH<0
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D.ΔH值与反应物用量无关
15.已知一定温度下合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1,在相同温度,相同体积的密闭容器中进行如下实验:①通入1molN2和3molH2达到平衡时放热为Q1;②通入2molN2和6molH2达到平衡时放热为Q2。则下列关系正确的是( )
A.Q2=2Q1 B.Q1>Q/2
C.2Q1<Q2<184.8kJ D.Q1=Q2<92.4 kJ
16.在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:
X(s)+2Y(g) 2Z(g) 此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.容器内各物质的浓度不变
C.容器内X、Y、Z的浓度之比为1︰2︰2
D.单位时间消耗0.1molX同时生成0.2molZ
17.反应:A(g)+3B(g) 2C(g) ΔH<0达平衡后,将气体混和物的温度升高,下列叙述中正确的是( )
A.正反应速率和逆反应速率变大,平衡向逆反应方向移动
B.正反应速率和逆反应速率变大,平衡向正反应方向移动
C.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
D.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
18.下列说法不正确的是( )
A.Na与H2O的反应是熵增的放热反应,该反应能自发进行
B.某吸热反应能自发进行,因此该反应是熵增反应
C.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
19.某温度下,在一容积固定的密闭容器中,反应2A(g)+B(s) 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度不变,对平衡混合物中三者的物质的量做如下调整,可使平衡左移的是( )
A.均增加1mol B.均减少1mol
C.均增加2mol D.均减少2mol
20.一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度改变的是( )
A.保持温度和容器体积不变,充入1molSO3(g)
B.保持温度和容器内压强不变,充入1molSO3(g)
C.保持温度和容器内体积不变,充入2molSO2(g)和2molO2(g)
D.保持温度和容器内体积不变,充入1molAr(g)
二、填空题(本大题共4小题,每题10分,共40分)
21.(10分)
I、有甲、乙两位同学根据所学化学知识,设计了由铜和硫酸为原料制取硫酸铜的两种方案:
方案1:铜与浓硫酸直接反应,即Cu→CuSO4, 方案2:由Cu→CuO→CuSO4。
试回答:这两种方案,你认为哪一种方案相比不够合理? 。请说明不选择该方案的理由: 。
II、目前,汽车尾气已成为许多大城市空气的主要污染源,汽车尾气中含有CO、NO等多种污染物。
(1)汽车燃料中一般不含氮元素,尾气中所含的NO是如何产生的?写出有关反应的方程式 。
(2)NO对大气的影响之一是导致酸雨,用化学方程式表示NO形成酸雨的原因是
。
(3)将CaCO3粉末喷洒到湖泊中,可消除酸雨对水质的影响,反应的离子方程式是
。
22.(10分)
A、B、C、D、E、F、G为由七种短周期元素构成的粒子,它们都有10个电子,其结构特点如下表:
粒子代号 | A | B | C | D | E | F | G |
原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
其中,D是由极性键构成的4原子极性分子;C常用作F的检验(加热)。
请填写下列空白:
(1)E离子结构示意图 ,D分子的电子式 。
(2)B的离子半径 E的离子半径(填<、>、=);
(3)写出实验室用两种方法制取D的化学方程式:
;
。
23.(10分)
甲醛是一种重要的化工产品,可利用甲醇催化脱氢制得:CH3OH(g)=HCHO(g)+H2(g) ΔH,如图表示该反应过程中的能量变化:
 加载中,请稍侯......
加载中,请稍侯......
精彩评论