人教版高中化学必修2《4.1开发利用金属矿物和海水资源》课时达标作业2(文件编号:21030929)
关注微信公众号:cc518xxzl 可免费领取本资料word完整版!
简介:
人教版高中化学必修2《4.1开发利用金属矿物和海水资源》课时达标作业2
一、选择题
1.(经典习题选萃)海水中含有的氯化镁,是镁的主要来源之一。从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入海水的水渠中加入石灰乳,沉淀、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥产物;④将得到的产物熔融电解。关于提取镁,下列说法不正确的是( )
A.此法的优点之一是原料来源丰富
B.进行①、②、③步骤的目的是从海水中提取MgCl2
C.第④步电解时阳极会产生氯气
D.以上提取镁的过程中涉及的反应有分解反应、化合反应和置换反应
答案:D
点拨:各步反应如下:①贝壳的主要成分是CaCO3,石灰乳的主要成分是Ca(OH)2。CaCO3高温CaO+CO2↑,
CaO+H2O===Ca(OH)2;
②MgCl2+Ca(OH)2===CaCl2+Mg(OH)2↓;
③Mg(OH)2+2HCl===MgCl2+2H2O;
④MgCl2(熔融)电解Mg+Cl2↑。
2.水资源非常重要,下列关于水的说法,错误的是( )
A.蒸馏法是海水淡化的方法之一
B.淡水的密度小于海水的密度
C.融化的雪水中矿物质含量比深井水中的少
D.0℃以上,温度越高,水的密度越小
答案:D
点拨:海水中溶有Na+、Mg2+、Cl-及SO4等离子,这些离子所组成的物质的沸点比水的沸点高,可用蒸馏的方法将其分离,A项正确。上述杂质的溶入使水溶液的密度增大,B项正确。雪和雨水的成分相同,是水蒸发后凝结而成的,含矿物质很少,而深井中的水不断与硅酸盐矿物质接触,其中溶有许多矿物质,C项正确。由于水在4℃时密度最大,在0℃~4℃,温度升高,水的密度增大。
3.下列不能作为海水淡化方法的是( )
A.蒸馏法 B.电渗析法
C.离子交换法 D.过滤法
答案:D
点拨:大量的盐分都溶解在海水中,过滤法不能达到海水淡化的目的。
4.(试题调研)检验海带中碘元素的实验中,发生如下反应:2H++2I-+H2O2===I2+2H2O,下列对该反应的叙述中不正确的是( )
A.I2为氧化产物
B.H2O2既作氧化剂又作还原剂
C.氧化性强弱顺序为H2O2>I2
D.生成1 mol I2时转移2 mol电子
答案:B

该反应中I2为氧化产物,H2O2作氧化剂,根据氧化性由强到弱的顺序为氧化剂>氧化产物,所以氧化性H2O2>I2;反应中每生成1 mol I2,转移2 mol电子。
5.从海水提取溴的过程中,有如下反应:5NaBr+NaBrO3+3H2SO4===3Br2+3Na2SO4+3H2O,与上述反应在原理上最相似的反应是( )
A.2NaBr+Cl2===Br2+2NaCl
B.AlCl3+3NaAlO2+6H2O===4Al(OH)3↓+3NaCl
C.2H2S+SO2===3S↓+2H2O
D.Cl2+H2O===HCl+HClO
答案:C
点拨:在5NaBr+NaBrO3+3H2SO4===3Br2+3Na2SO4+3H2O反应中,Br-被氧化,BrO3被还原,最后都生成Br2,在四个答案中,只有C选项中被氧化和被还原的元素为不同价态的同一元素(硫),最后都生成单质硫,两者的原理最相似。
6.(试题调研)从海水中提取的溴占世界溴年产量的3左右。已知溴水呈橙色,将SO2气体通入溴水时,可以使溴水褪色。则下列有关叙述中正确的是( )
A.SO2使溴水褪色,显示了SO2的漂白性
B.SO2使溴水褪色,显示了SO2的还原性
C.从溴水中提取单质溴,可以用乙醇进行萃取
D.SO2是形成酸雨的唯一污染物
答案:B
点拨:因为SO2具有较强的还原性,而溴单质具有较强的氧化性,将SO2气体通入溴水时,发生反应:SO2+Br2+2H2O===H2SO4+2HBr而使溴水褪色。由于乙醇和水互溶,故不能作萃取剂(从溴水中提取溴)。酸雨有硫酸酸雨(主要由SO2导致)和硝酸酸雨(主要由NO和NO2导致)两种。
7.从海水中可以提取溴,主要反应为:2Br-+Cl2===2Cl-+Br2。下列说法正确的是( )
A.溴离子具有氧化性
B.氯气是还原剂
C.该反应属于复分解反应
D.氯气的氧化性比溴单质强
答案:D
点拨:从反应的离子方程式可得,海水中的溴离子被氯气氧化成溴单质,所以氯气的氧化性比溴单质强(氧化剂的氧化性大于氧化产物的氧化性)。
8.海水资源的利用具有非常广阔的前景。下列关于海水资源利用的说法中不正确的是( )
A.电解法分解海水,制取洁净的热能资源氢气
B.采用太阳光照射法晒制工业用食盐
C.针对能量现状,大力开发潮汐能和波浪能
D.铀是海水中的微量元素,但核工业的铀主要从海水中提取
答案:A
9.高分子分离膜可以让某些物质有选择地通过而将物质分离,下列应用不属于高分子分离膜的应用范围的是( )
A.分离工业废水,回收废液中的有用成分
B.食品工业中,浓缩天然果汁,乳制品加工和酿酒
C.将化学能转换成电能,将热能转换成电能
D.海水的淡化
答案:C
点拨:分离物质用高分子膜的有海水淡化,废水处理、食品加工、电解饱和食盐水。但在发电过程中无论是化学能还是热能转化为电能时,都不用高分子膜。
10.若将海水淡化作饮用水使用,下列方法在原理上完全不可行的是( )
A.加明矾使海水中的盐分沉淀而淡化
B.利用太阳能使海水蒸馏淡化
C.将海水缓慢凝固以获取淡化的饮用水
D.将海水通过离子交换树脂,以除去所含离子
答案:A
点拨:明矾净水是利用Al3+水解生成的Al(OH)3胶体的吸附作用而除去水中的一些悬浮物,并不能除去海水中的阴、阳离子而使海水淡化。利用太阳能使海水蒸馏淡化,是有研究价值的一种淡化途径。海水缓慢凝固后可结成冰,在这个过程中可以除去海水中的离子而淡化。将海水通过离子交换树脂使海水淡化是一种已被应用的海水淡化方法。
二、非选择题
11.(经典习题选萃)某同学从科普书中摘录了从海水中提取溴的方法,请仔细阅读,然后回答问题。
在海水中溴以溴化镁和溴化钠形式存在。经过晒盐后的卤水中,溴的含量提高了100倍左右。只要把卤水加入反应塔中,通过氯气和水蒸气蒸馏,就可以把“溴”蒸出来。也有借助煤油从海水中提取溴的,煤油用过之后,还可以回收。土法提取溴可用浓盐酸作用于漂白粉或用二氧化锰氧化浓盐酸制取氯提取溴。
请回答以下几个问题:
(1)卤水中通入Cl2时发生反应的离子方程式为:
______________________________________________________。
(2)通过水蒸气就可把溴蒸出来的原因是________________________________________________________________________________________________________________________________________________。
(3)借助煤油从海水中提取溴是利用了溴的________性质。
答案:(1)2Br-+Cl2===Br2+2Cl- (2)因为溴单质易挥发 (3)易溶于有机溶剂
点拨:海水提溴的方法是首先浓缩海水,再用氧化剂将Br-氧化成Br2,由于Br2易挥发、易溶于有机溶剂,所以可利用通入水蒸气或加入煤油的方法将溴提取出来。
12.(2012·昆明高一检测)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:

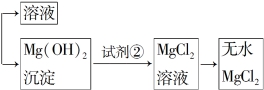
熔融
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用________,要使MgSO4完全转化为沉淀,加入试剂的量应为________。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是______________________________________________。
(3)试剂②选用________;写出其反应的离子方程式
________________________________________________________________________________________________________________________________________________。
(4)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为______________________________________ __________________________________。
答案:(1)石灰乳 过量 (2)过滤
(3)盐酸 Mg(OH)2+2H+===Mg2++2H2O
(4)MgCl2(熔融)电解Mg+Cl2↑
点拨:(1)工业上常加入廉价的石灰乳使海水中的MgSO4转化为Mg(OH)2;为使MgSO4完全转化为Mg(OH)2,应加入过量石灰乳。
(2)加入石灰乳产生Mg(OH)2,通过过滤将Mg(OH)2分离出来。
(3)用盐酸溶解Mg(OH)2,反应的离子方程式为Mg(OH)2+2H+===Mg2++2H2O。
(4)工业上电解熔融MgCl2制取Mg,反应的化学方程式为MgCl2(熔融)电解Mg+Cl2↑。
13.某同学为了验证海带中含有碘元素,拟进行如下实验,请完成相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中不会用到的实验仪器有________(填代号)。
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三脚架
E.泥三角 F.酒精灯 G.烧杯 H.量筒
(2)第2步:I-溶液的获取。操作是______________________ _____________________________________________________________________________________________________________________。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用________(填代号)。
A.浓硫酸 B.新制氯水
C.酸性KMnO4溶液 D.H2O2
理由是________________________________________________。
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含有碘元素。
答案:(1)AGH (2)将灰烬转移到烧杯中,加适量蒸馏水,用玻璃棒充分搅拌,煮沸,过滤 (3)D 双氧水又称“绿色氧化剂”,其参加氧化还原反应时还原产物为H2O,无污染且不引入新的杂质
点拨:本题给出实验任务和步骤,考查对实验原理的理解以及如何选择仪器、试剂等有关实验能力。解答本题时要结合化学实验基本操作中有关分离、提纯操作要求,弄清每步操作的目的才能正确解答。
(1)先分析灼烧固体物质所用的仪器有哪些,然后再选出不会用到哪些仪器。(2)海带灼烧后的灰烬中含有可溶性碘盐和难溶固体物质。要得到含有I-的溶液,须将灰烬充分溶解,并过滤以除去残渣。(3)浓硫酸、新制氯水、酸性KMnO4溶液、H2O2均能将I-氧化为I2。前三者会引入新杂质,而H2O2的还原产物为H2O,无其他物质生成,所以氧化剂最好选用H2O2。
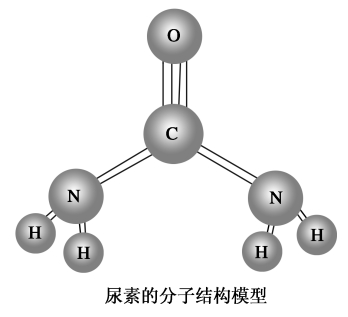
无机化合物转化为有机化合物
历史上曾经有人认为,有机化合物只能由生物的细胞在一种特殊力量——生命力的作用下产生,人工合成有机物是不可能的。1828年,德国化学家维勒(F.Wöhler,1800~1882)通过蒸发氰酸铵(NH4CNO,一种无机化合物,由氯化铵和氰酸银反应制得)水溶液得到了尿素[CO(NH2)2]。尿素的人工合成,揭开了人工合成有机物的序幕。
 加载中,请稍侯......
加载中,请稍侯......
精彩评论