高考真题实验专题
2013高考全国理综新课标226.(15)正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
发生的反应如下:
CH3CH2CH2CH2OHeq o(s\up 0(),sdo -8(Na2Cr2O7) ,sdo 7(H2SO4 △))CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
实验步骤如下:
将6.0gNa2Cr2O7放入100 mL烧杯中,加30mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由 。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法是 。
(3)上述装置图中,B仪器的名称是 ,D仪器的名称是 。
(4)分液漏斗使用前必须进行的操作是 (填正确答案标号)。
a.润湿b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在 层(填"上"或"下")。
(6)反应温度应保持在90~95℃,其原因是 。
(7)本实验中,正丁醛的产率为 %。
2013高考全国理综新课标126.(13分)醇脱水是合成烯烃的常用方法,实验室合成环乙烯的反应和实验装置如下:
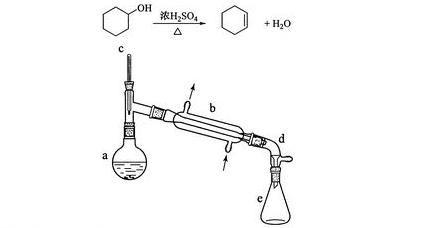
可能用到的有关数据如下:
合成反应:
在a中加入20g环乙醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环乙烯10g。
回答下列问题:
(1)装置b的名称是________________。
(2)加入碎瓷片的作用是____________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加B.冷却后补加C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为_________。
(4)分液漏斗在使用前须清洗干净并_______;在本实验分离过程中,产物应该从分液漏斗的_____________(填"上口倒出"或"下口倒出")。
(5)分离提纯过程中加入无水氯化钙的目的是_____________。
(6)在环乙烯粗产物蒸馏过程中,不可能用到的仪器有__________(填正确答案标号)。
A.圆底烧瓶B.温度计C.吸滤瓶D.球形冷凝管E.接收器
(7)本实验所得到的环乙烯产率是______________(填正确答案标号)。
A.41%B.50%C.61%D.70%
2014高考全国理综新课标228.(15分)某小组以CoCl2·6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验:
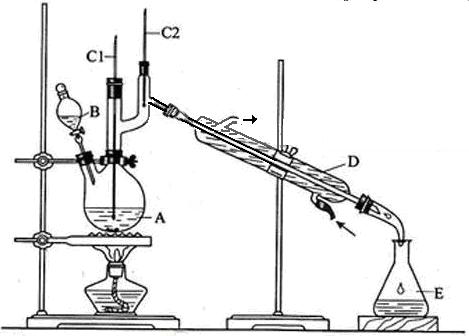
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1 ml c1 mol·L-1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 ml NaOH溶液。
②氯的测定:准确称取样品X配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不在消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是 。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,可使用的指示剂为 。
(3)样品中氨的质量分数表达式为 。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填"偏高"或"偏低")。
(5)测定氯的过程中,使用棕色滴定管的原因是 :滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1 ,c(CrO42-)为 mol·L-1 mol。(已知:Ksp(Ag2CrO4)= 1.12×10-12)
(6)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,钴的化合价为 。制备X的化学方程式为 :X的制备过程中温度不能过高的原因是 。
2015高考全国理综新课标228.(15 分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问題:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
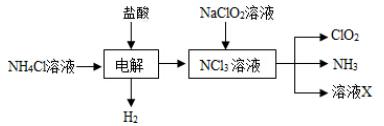
①电解时发生反应的化学方程式为 。
②溶液X中大量存在的阴离子有__________。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
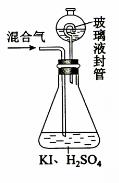
(3)用右图装置可以测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入 3 mL 稀硫酸:
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为 。
②玻璃液封装置的作用是 。
③V中加入的指示剂通常为 ,滴定至终点的现象是 。
④测得混合气中ClO2的质量为 g。
(4)用ClO2处理过的饮用水会含有一定最的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是_______(填标号)。
a.明矾 b.碘化钾c.盐酸 d.硫酸亚铁
2016高考全国理综新课标2,28.(15分)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_____________。
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____________。
(4)丙组同学取10mL0.1mol·L-1KI溶液,加入6mL0.1 mol·L-1 FeCl3溶液混合。分别取 2 mL 此溶液于3支试管中进行如下实验:
①第一支试管中加入1mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为_______。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是______________________,生成沉淀的原因是__________________________(用平衡移动原理解释)。
2017高考全国理综新课标2,28.(15分)
水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I−还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O32- + I2=2I− + S4O62-)。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。
(2)"氧的固定"中发生反应的化学方程式为_______________。
(3)Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和
____________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除____及二氧化碳。
(4)取100.00 mL水样经固氧、酸化后,用a mol·L−1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为_________mg·L−1。
(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏___________。(填"高"或"低")
2017高考全国理综新课标1,26.(15分)凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:NH3+H3BO3=NH3·H3BO3;NH3·H3BO3+HCl= NH4Cl+ H3BO3。
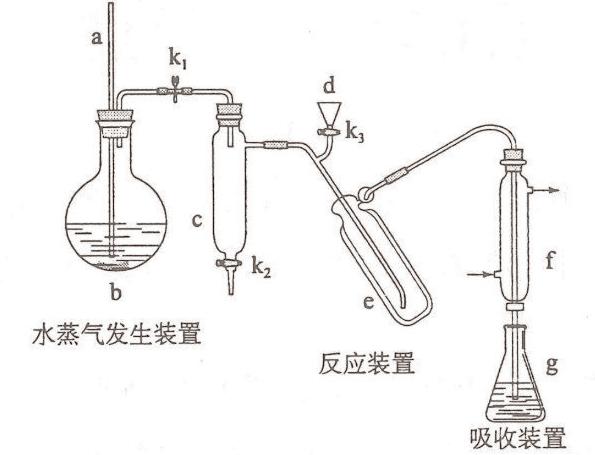
回答下列问题:
(1)a的作用是_______________。
(2)b中放入少量碎瓷片的目的是____________。f的名称是__________________。
(3)清洗仪器:g中加蒸馏水:打开k1,关闭k2、k3,加热b,蒸气充满管路:停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是____________;打开k2放掉水,重复操作2~3次。
(4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d中保留少量水。打开k1,加热b,使水蒸气进入e。
①d中保留少量水的目的是___________________。
②e中主要反应的离子方程式为________________,e采用中空双层玻璃瓶的作用是________。
(5)取某甘氨酸(C2H5NO2)样品m 克进行测定,滴定g中吸收液时消耗浓度为cmol·L-1的盐酸V mL,则样品中氨的质量分数为_________%,样品的纯度≤_______%。
2017高考全国理综新课标326.(14分)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
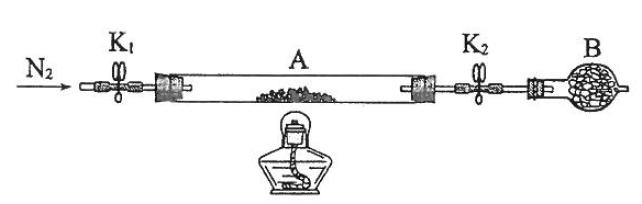
①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热b.熄灭酒精灯c.关闭K1和K2
d.打开K1和K2,缓缓通入N2e.称量Af.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填"偏大""偏小"或"无影响")。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
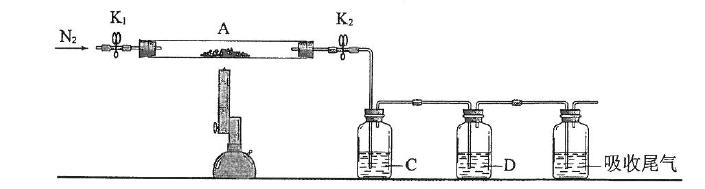
①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。
a.品红b.NaOHc.BaCl2d.Ba(NO3)2e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式__________________
 加载中,请稍侯......
加载中,请稍侯......
精彩评论