小学、初中、高中各年级各学科学习资料,加微信:13353111130 领取!
氧化还原反应的电子转移既可以发生在不同 种元素之间也可以发生在同种元素之间。那么,发生在同种元素之间的氧化还原反应应遵循什么规律呢?
同种元素间氧化还原反应需遵循的规律
(1)歧化反应,同一分子的同种元素同种价态发生氧化还原反应时,其价态为中间变两头(一高一 低),即同一元素化合价相同的原子,一些原子的化合 价升高,另外一些原子的化合价降低。
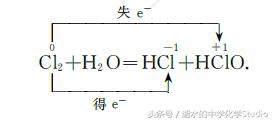
在上述反应中,反应物中Cl元素化合价由0价 既升为+1价,又降为一 1价,得失电子数均为1,Cl2 既作氧化剂又作还原剂,又如:
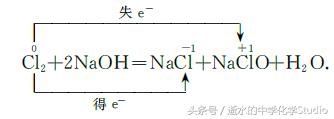
(2)归中反应:同一元素由不同价态转化为该 元素同一价态的反应.即同一元素不同价态相同的原 子,一些原子的化合价升高,另外一些原子的化合价降低,最后得到产物中该元素价态相同。

在上述反应中,反应物H2S中S元素化合价由 一2价升为+ 1价,SO2中S元素化合价由+4价降为 一 1价.得失电子数均为4,既是氧化产物又是还原产物。又如:
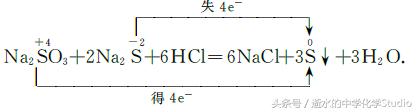
(3)其他类型的反应遵循“价态归中”规律,“价 态归中,只靠拢,不相交”是指同种元素不同价态原子 间发生氧化还原反应,反应后生成中间价态的物质, 即化合价低的升高,化合价高的降低,但升高后的化 合价不应该高于降低后的化合价。

上述反应中,元素的化合价应从一2价变化为0 价,从+ 6价变化为+ 4价.而不能认为是从一2价变 化为+ 4价,+6价变化为0价。又如:

典例剖析
例氢化钙(CaH2)可作为生氢剂,反应的化学 方程式为CaH2+2H2O=Ca(OH)+2H2,下列说 法不正确的是( ).
A 、CaH2既是还原剂,又是氧化剂;
B、 H2既是氧化产物,又是还原产物;
C、 CaH2是还原剂,H2O是氧化剂;
D、氧化产物与还原产物质量比为1:1
此题的关键是分析判断出CaH2中氢元素的 化合价为一1价,因金属元素钙不可能有负价态,在化合物中钙元素只有+2价。答案为A。
4、同种元素不同价态间氧化还原反应能否发生的判断方法
(1)具有相邻价态(即无中间价态)时不发生氧化 还原反应,如Fe与FeCl2之间无反应.又如SO2气体虽然是强还原剂,浓H2SO4是强氧化剂,但SO2可以用浓硫酸干燥而不会发生反应,因为在S的+4价与 + 6价之间无其他价态了.
(2) 具有中间价态时可发生反应,如Fe与FeCl3反应生成中间价态的FeCl2
(3)邻位价态规律:氧化还原反应发生时,其价态一般变为邻位价态。如H2S→S; Cl→Cl-

 加载中,请稍侯......
加载中,请稍侯......
精彩评论