所谓“守恒”就是物质在发生“变化”或两物质在发生“相互作用”的过程中某些物理量的总量保持“不变”。一切化学反应都遵循守恒定律,在化学变化中有各种各样的守恒,如质量守恒、元素守恒、得失电子守恒、电荷守恒、能量守恒等!
1.1 质量守恒法
它是根据化学反应前后反应物的总质量与生成物的总质量相等的原理进行计算或推断的方法。主要包括反应物总质量与生成物总质量守恒;反应中某元素的质量守恒;结晶过程中溶质总质量守恒;可逆反应过程中总质量守恒等。
答题要点:
第一步:明确题目要求解的量。
第二步:根据题目中要求解的量,分析反应过程中物质的变化,找出质量守恒的物质及与其相关的量。
第三步:根据质量守恒的原理,梳理出反应前后反应物的总质量与生成物的总质量,列式计算求解。
调研试题:
【调研1】现有一块铝铁合金,为测定其中铝的含量,做如下实验:切一小块合金,将其溶于盐酸,然后加入足量的氢氧化钠溶液,待溶液中的沉淀全部变成红褐色时,过滤沉淀物并在空气中灼烧,最后所得红棕色粉末的质量恰好跟原来的合金试样质量相等。则合金中铝的质量分数为
A.25%B.30%C.46%D.70%
【思路点拨】第一步,弄清从合金到最后得到红棕色粉末的过程中铁元素的转化;第二步,根据题意得出合金中铝的质量与氧化铁中氧的质量相等的结论;第三步,利用质量守恒定律列式计算。
【试题解析】铁、铝两种元素在整个化学变化过程中的转化形式如图所示:
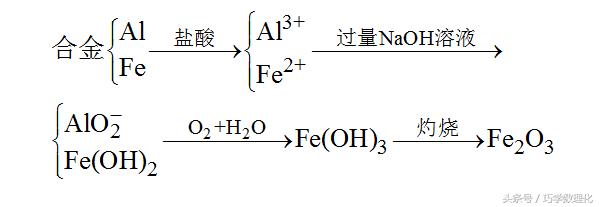
根据上图知,最后得到的红棕色粉末为氧化铁,根据题意知反应前合金的质量等于最后得到的Fe2O3的质量,因铁元素在各步反应中完全转化,即铁元素的质量守恒,则合金中铝的质量等于Fe2O3中氧元素的质量,所以合金中铝的质量分数为

1.2 原子守恒法
它是依据反应前后原子的种类及个数都不变的原理进行推导或计算的方法。当遇到两种或两种以上物质组成的混合物的计算类试题时,一般会涉及多个反应,若按常规方法计算需先写化学方程式,然后列方程组求解,非常烦琐,此时,可采用“原子守恒法”解题。
答题要点:
第一步:仔细分析题目中给出的信息,找出反应前后守恒的原子。
第二步:分别写出反应前后含守恒原子的物质及其物质的量,找出反应前后它们之间的关系。
第三步:运用原子守恒,列出关系,根据已知元素原子的物质的量,依据反应前后原子的种类及个数不变的原理列出守恒关系。
调研试题:
【调研2】将1.92 g铜粉与一定量浓硝酸反应,当铜粉完全反应时收集到NO2和NO的混合气体1.12 L(标准状况),则消耗硝酸的物质的量是
A.0.12 mol B.0.11 mol C.0.09 mol D.0.08 mol
【思路点拨】第一步,分析原子的去向,找出守恒的原子;第二步,找出守恒原子的存在形式,并写出它们的存在形式;第三步,利用原子守恒进行计算。
【试题解析】由题意可知参加反应的HNO3一部分生成Cu(NO3)2,另一部分变成NO2或NO。利用反应前后N原子守恒,可以轻松求解。HNO3与Cu反应,HNO3一部分起酸的作用,即生成Cu(NO3)2,用去硝酸的物质的量为:
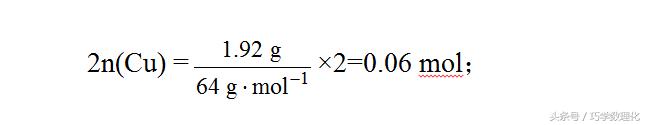
另一部分HNO3起氧化作用,不管生成的1.12 L气体为何种成分,都是HNO3的还原产物,且有HNO3~NO,HNO3~NO2,所以起氧化作用的HNO3的物质的量为:
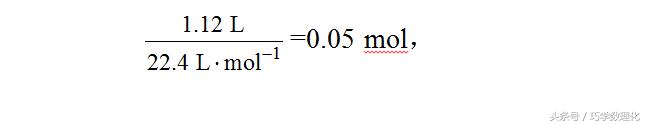
故共消耗HNO3的物质的量为0.06 mol + 0.05 mol = 0.11 mol。
1.3 得失电子守恒法
它是依据氧化还原反应中得失电子总数相等的原理进行推导和计算的方法。它广泛应用于氧化还原反应中的各种计算,甚至包括电解产物的计算。得失电子守恒法常用于解答有关复杂氧化还原反应的计算和配平问题。
答题要点:
第一步:得失电子只有在氧化还原反应中才存在,故要明确只有氧化还原反应才可能用到得失电子守恒法,非氧化还原反应不能使用此方法。
第二步:根据题意,再结合已学知识,判断出氧化剂、还原剂、氧化产物和还原产物。
第三步:根据氧化剂或还原剂在反应前后化合价的变化,确定它们所含的一个原子(或离子)得到或失去的电子数。
第四步:根据氧化剂得到的电子数一定等于还原剂失去的电子数,列出等式:n(还原剂)×升价元素的原子个数×化合价升高值=n(氧化剂)×降价元素的原子个数×化合价降低值。
调研试题:
【调研3】羟胺(H2NOH)是一种还原剂,能将某些氧化剂还原。现用25 mL 0.049 mol·L-1的羟胺酸性溶液跟足量的Fe2(SO4)3溶液在煮沸条件下反应,生成的Fe2+恰好与24.50 mL 0.02 mol·L-1的酸性KMnO4溶液作用:FeSO4+KMnO4+H2SO4→Fe2(SO4)3+K2SO4+MnSO4+H2O,则在上述反应中,羟胺的氧化产物是
A.N2 B.N2O C.NO D.NO2
【思路点拨】第一步,明确氧化剂、还原剂、氧化产物和还原产物;第二步,找出氧化剂与还原剂的得失电子情况;第三步,根据得失电子守恒列出等式并计算得出结果。
【试题解析】Fe2(SO4)3被羟胺还原为FeSO4,FeSO4又被酸性KMnO4溶液氧化为Fe2(SO4)3,相当于未参加氧化还原反应。故可认为还原剂是羟胺,氧化剂是KMnO4。羟胺中氮元素在反应前为-1价,设反应后氮元素为n价,则有25×10-3 L×0.049 mol·L-1×(n+1)=24.50×10-3L×0.02 mol·L-1×(7-2),解得n=1。
1.4 电荷守恒法
它是利用反应前后离子所带电荷总数不变的原理进行推导或计算的方法。常用于溶液中离子浓度关系的推断,也可用此原理列等式进行有关反应中某些量的计算。解答电解质溶液中的计算问题常用电荷守恒法,溶液中的电荷守恒是一种隐含条件,应注意每种阴、阳离子所带电荷数是该离子的物质的量与每个离子所带电荷数的乘积。
答题要点:
第一步:根据题意,分析过程中发生的反应,据此确定反应后的某一终点溶液。
第二步:在终点溶液中找出所有的阴、阳离子,根据题目中所提供的物质的物质的量,分别计算出各种离子的物质的量。
第三步:根据溶液中电荷守恒列出等式。
调研试题:
【调研4】将0.1 mol的镁、铝混合物溶于100 mL 2 mol·L-1 H2SO4溶液中,然后再滴加1 mol·L-1 NaOH溶液。请回答下列问题:
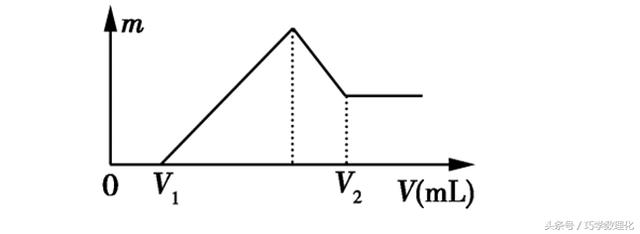
(1)若在滴加NaOH溶液的过程中,沉淀的质量m随加入NaOH溶液的体积V变化如图所示。当V1=160 mL时,则金属粉末中n(Mg)=______mol,V2=___________mL。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=___________mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol·L-1 H2SO4溶解此混合物后,再加入450 mL 1 mol·L-1 NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
【思路点拨】在解答本题时,第一步分析出各段的反应情况,第二步确定加入不同体积的NaOH溶液时溶液中存在的离子,第三步找出各种离子之间的关系并根据电荷守恒关系列式计算。
【试题解析】(1)由图知,在0~V1段,加入NaOH溶液无沉淀析出,说明与Mg、Al反应的H2SO4过量,Mg、Al完全溶于硫酸,故在V1处,加入的NaOH溶液恰好将过量的H2SO4完全中和,溶液中有Na+、Mg2+、Al3+、SO42-(H+、OH−忽略,下同)。根据电荷守恒得:1 mol·L-1×0.16 L+2n(Mg)+3n(Al)=2×0.1 L×2 mol·L-1,又有n(Mg)+n(Al)=0.1 mol,所以,n(Mg)=0.06 mol,n(Al)=0.04 mol。在V2处,Al(OH)3恰好完全溶解,溶液中有Na+、AlO2-、SO42-,根据电荷守恒得:1 mol·L-1×V2×10-3 L·mL-1=0.04 mol+2×0.1 L×2 mol·L-1,所以V2=440 mL。
(2)当Mg2+、Al3+刚好沉淀完全时,溶液中有Na+、SO42-,根据电荷守恒得:1 mol·L-1×V(NaOH)×
10-3L·mL-1=2×0.1 L×2 mol·L-1,所以V(NaOH)=400 mL。
(3)当加入450 mL 1 mol·L-1NaOH溶液时,所得沉淀中无Al(OH)3,此时NaOH有可能恰好反应,也可能过量,因此溶液中有Na+、AlO2-、SO42-,还有可能有过量的OH-。根据电荷守恒得:
1mol·L-1×450×10-3L=0.1(1-a)mol+2×0.1L×2 mol·L-1+n(OH-)。则1 mol·L-1×450×10-3L≥0.1(1-a) mol+2×0.1 L×2 mol·L-1,所以a≥0.5,又a<1,因此0.5≤a<1。
答案:(1)0.06 440 (2)400 (3)0.5≤a<1
1.5 物料守恒法
它是依据反应物中的元素原子(核)个数种类、总数对应相等于生成物中的元素原子(核)个数种类、总数的原理进行推导或计算的方法。物料守恒和电荷守恒、质子守恒同为溶液中的三大守恒关系。
答题要点:
第一步:判断溶液中是否存在反应。若不存在反应,则直接考虑电离或水解;若存在反应,则先考虑反应。
第二步:找出盐溶液中发生电离或水解的离子。
第三步:首先将溶液中含有该种离子的主要元素的所有微粒找出,其次将各微粒的量分别乘以其相应的原子个数,最后将各微粒的量相加得到该离子在溶液中的总量。
第四步:根据溶液中的物料关系,建立水解离子的总量与盐溶液中不水解离子的量的关系,从而推导计算出其他离子浓度的关系。
调研试题:
【调研5】25 ℃时,取0.2 mol·L-1 HX溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)不正确的是
A.混合溶液中由水电离出的c(OH−)<0.2 mol·L-1 HX溶液中由水电离出的c(H+)
B.c(Na+)=c(X-)+c(HX)=0.1 mol·L-1
C.c(Na+)-c(X-)=9.9×10-7 mol·L-1
D.c(OH-)-c(HX)=1×10-8 mol·L-1
【思路点拨】第一步,判断反应后溶液中的溶质;第二步,分析哪种离子发生电离或水解;第三步,判断电离或水解产生的离子或分子,并考虑溶液中离子的电离或水解程度,分析离子浓度的大小。
【试题解析】由题意知,HX与NaOH恰好完全反应,反应后溶液显碱性,说明HX为弱酸,故NaX水解促进水的电离,而HX电离抑制水的电离,A错误;由于混合后溶液体积变为原来的两倍,故由物料守恒得:c(Na+)=c(X-)+c(HX)=0.1 mol·L-1,B正确;由电荷守恒c(Na+)+c(H+)=c(X-)+c(OH-)可得,c(Na+)-c(X−)=c(OH−)−c(H+)=9.9×10-7mol·L-1,C正确;将混合后溶液的物料守恒式代入电荷守恒式得:c(OH−)−c(HX)=c(H+)=1×10-8mol·L-1,D正确。

 加载中,请稍侯......
加载中,请稍侯......
精彩评论