例1. 下列关于酸、碱、盐说法正确的是( )
A.pH大于7的溶液一定是碱的溶液
B.碱溶液与盐溶液发生复分解反应后,溶液的总质量可能不变
C.浓硫酸敞口放在空气中溶质质量分数会变小的原因是浓硫酸易挥发
D.能使紫色石蕊试液变蓝的溶液一定能使无色酚酞试液变红
解析:A.pH大于7的溶液不一定是碱的溶液,还有可能是盐的溶液,故A错误;B.碱溶液与盐溶液发生复分解反应,生成物总有气体或沉淀,故反应后溶液的总质量减少,故B错误;C.浓硫酸易吸水,敞口放在空气中会因为吸收空气中的水分而使其溶质质量分数变小,故C错误;D.能使紫色石蕊试液变蓝的溶液是碱性溶液,也能使无色酚酞试液变红,故D正确。
答案:D。
例2.下列关于溶质质量分数为98%浓硫酸性质的说法错误的是( )
A.浓硫酸的密度大于水的密度
B.浓硫酸与水混合时溶液温度迅速升高
C.浓硫酸因具有很强的吸水性而被装入干燥器中使用
D.浓硫酸腐蚀衣物和皮肤是物理变化
解析:浓硫酸的密度是1.84 g/cm3,水则为1 g/cm3,浓硫酸的密度大于水的密度;浓硫酸溶于水时温度升高;浓硫酸具有很强的吸水性,常用作干燥剂;浓硫酸具有很强的腐蚀性,是化学变化,故D错,A、B、C均正确。
答案:D
例3.对盐酸的叙述正确的是( )
A.盐酸是氯化氢气体的水溶液
B.纯净的盐酸往往带有黄色
C.盐酸使无色酚酞试液变红
D.盐酸具有强烈的吸水性
解析:盐酸:是氯化氢气体的水溶液。俗称胃酸。浓盐酸是无色,有刺激性气味液体,具有挥发性性,盐酸与酚酞不变色。而浓硫酸具有吸水性。选A
答案:A
例4.氢氧化钠溶液和氢氧化钙溶液具有相似的化学性质,其本质原因是( )
A.都能与指示剂作用
B.都能解离出氢氧根离子
C.都能解离出金属阳离子
D.都含有氢元素和氧元素
解析:氢氧化钠溶液和氢氧化钙溶液具有相似的化学性质,其本质原因是在水溶液中都能电离出氢氧根离子。故选B。
答案:B
例5.将浓硫酸、浓盐酸敞口放置一段时间,它们的共同变化是( )
A.颜色发生改变B.发生化学变化
C.质量减少D.溶质的质量分数变小
解析:浓硫酸有吸水性,腐蚀性。而浓盐酸有挥发性。吸水性,挥发性是物理变化;腐蚀性是化学变化。则A、B不对。浓盐酸挥发其的质量减少,浓硫酸吸水其的质量增加,而且溶质的质量分数减少,则C错,D对。
答案:D
例6、下列物质的用途不正确的是( )
A.氮气用于食品防腐 B.干冰用于人工降雨
C.盐酸用于清除铁锈 D.氢氧化钠用于治疗胃酸过多
解析:氮气的性质稳定,不易参与反应。可以用于食品的防腐。干冰是二氧化碳的固体可以用于降雨。铁锈的成分是三氧化二铁,盐酸可以和金属氧化物反应,则A、B、C都对。D选项治疗胃酸用小苏打或者氢氧化铝,氢氧化钠有腐蚀性。D错
答案:D
例7.有甲、乙、丙三种溶液,甲溶液能使紫色石蕊试液变红色,乙溶液能使紫色石蕊试液变蓝色,丙溶液不能使紫色石蕊试液变色。这三种溶液的pH由大到小的顺序是( )
A.乙>丙>甲 B.甲>乙>丙 C.丙>乙>甲 D.甲>丙>乙
答案:A
例8.某班甲、乙两组同学分别做常见酸和碱与指示剂反应的实验,使用的试剂有稀盐酸、稀硫酸、氢氧化钠溶液和酚酞试液。实验后废液分别集中到各组的一个废液缸中。研究小组对两个组的废液进行检测,结果如下表。下列说法错误的是(不考虑酚酞和水)( )

A.甲组废液中一定含有稀盐酸和稀硫酸
B.乙组废液中一定含有氢氧化钠、氯化钠、硫酸钠
C.直接将甲组的废液排入铸铁管下水道,可能腐蚀铸铁水管
D.将两组的废液处理后再排放,防止污染
答案:A
例9.观察和实验是学习化学的重要方式,下列实验中观察到的颜色正确的是( )
A.铁锈放入稀盐酸中溶液变黄色
B.酚酞试液滴入硫酸溶液中变红色
C.硫在氧气中燃烧发出微弱的淡蓝色火焰
D.硫酸铜溶液中滴加氢氧化钠溶液出现红褐色絮状沉淀
答案:A
例10.如图甲、乙、丙是三种不同类别的物质,且均能与X发生化学反应。若X为稀盐酸,则甲、乙、丙三种物质可能为( )
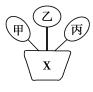
A.Cu、Ca(OH)2、CaCO3
B.Mg、NaOH、Ca(OH)2
C.Fe、CuO、Cu(OH)2
D.Zn、Fe2O3、NaNO3
答案:C
例11.七水硫酸镁(MgSO4·7H2O)是一种重要的化工原料,在48.1℃以下的潮湿空气中稳定,在温热干燥空气中易失去结晶水。工业上将白云石(主要成分为MgCO3、CaCO3)煅烧成粉,用于制取MgSO4·7H2O,工艺流程如下图所示:
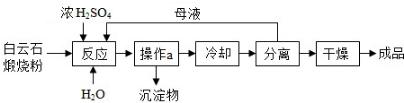
(1)煅烧过程中,MgCO3转化为MgO的基本反应类型是______________________。
(2)写出MgO与H2SO4反应的化学方程式_________________________。
(3)操作a的名称为________________。
(4)将分离后的母液循环利用的目的是_______________________________。
(5)干燥得成品时,需要控制的条件是__________________________________。
答案:(1)分解反应 (2)MgO+H2SO4=MgSO4+H2O (3)过滤 (4)提高原料利用率 (5)温度
例12、 构建模型和构建知识网络是化学学习中重要的学习方法,李华同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题:
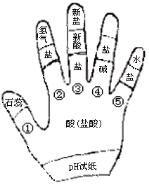
(1)如用湿润的pH试纸测定盐酸的pH,则结果会_________(填“偏大”、“偏小”、“无影响”)。
(2)图中①的现象是:__________________________。
(3)写出一个符合图中③的化学方程式______________。
(4)图中性质④属于__________________反应(填基本反应类型)。
(5)图中⑤的性质在工业上可用于____________________(填用途)。
答案:(1)偏大 (2)石蕊变红 (3)HCl+AgNO3=AgCl↓+HNO3(合理即可) (4)复分解(5)盐酸除铁锈(合理即可)
例13.地震发生的成因很复杂。据研究,孕震过程中比较活泼的物质有CO2、氢等。
Ⅰ.孕震过程中,在地壳的岩层中碳酸盐受热发生如下反应:
CaCO3==CaO+CO2↑
MgCa(CO3)2==MgO+CaO+2CO2↑
(1)上述两个反应的特点是: 反应类型均为 ;
(2)正确书写化学方程式:上述两个反应式还应补充 。
(3)当地应力(压力)增大时,CO2在地下水中溶解度增大,同时使得水的pH
(填“增大”、“减小”或“不变”)
Ⅱ.氢在目前的地震预测中被公认为是一种灵敏元素。一般认为,地壳中水蒸气和氧化亚铁(FeO)作用会产生氢气和氧化铁(Fe2O3)该反应的化学方程式为 。
答案:Ⅰ(1)一种物质生成几种物质;分解反应 ;(2)高温 ; (3)减小
Ⅱ H2O+2FeO==Fe2O3+H2
例14.酸和碱是中学化学中重点研究的物质。请回答下列问题。
(1)胃乐新胶囊是一种治疗胃酸过多的药物,部分说明见下表。人体胃液中含有适量的胃酸,胃酸的主要成分是 ,胃乐新胶囊中的主要成分与胃酸发生反应的化学方程式为 。

(2)小华在盛有氢氧化钠溶液的试管中,加入酚酞后,又加入了稀盐酸,得到A溶液呈无色,他认为盐酸和氢氧化钠恰好完全中和,小明认为他的结论不正确,原因是 。
(3)酸、碱的中和反应,不仅发生在盐酸、硫酸等无机酸中,也可发生在有机酸中(如甲酸)。甲酸与氢氧化钠反应的化学方程式为HCOOH+NaOH=HCOONa+H2O,请你写出甲酸与氢氧化钙的化学方程式: 。
答案: (1)稀盐酸 Al(OH)3+3HCl+AlCl3+3H2O (2)加入酚酞后溶液不变色,有两种可能。一种可能是酸碱恰好完全中和,另一种是盐酸过量(或盐酸过量,酚酞也不变色)
(3)2HCOOH+Ca(OH)2=(HCOO)2Ca+2H2O

 加载中,请稍侯......
加载中,请稍侯......
精彩评论