课时训练(六) 常见的酸和碱
1.[2017·上海]氢氧化钙俗称( )
A.烧碱 B.纯碱
C.熟石灰 D.石灰石
2.[2017·广州]下列关于H2SO4性质描述中,不属于酸的通性的是( )
A.使紫色石蕊溶液变红
B.与NaOH发生中和反应
C.浓硫酸滴到白纸上使纸变黑
D.与Mg反应放出氢气
3.[2017·深圳]小明同学归纳总结了初中所学稀硫酸的化学性质,并用"H2SO4+X→盐+Y"这种表达式进行整理。下列小明的观点错误的是( )
4.[2017·潍坊]类比推理在化学学习和科学研究中有重要意义。下列类比推理正确的是( )
A.NaOH和KOH都是强碱,两者都能与硫酸铜溶液反应生成蓝色沉淀
B.N2和O2都是非金属单质,两者的化学性质都非常活泼
C.盐酸和硫酸都是强酸,两者都易挥发
D.CaO和Fe2O3都是金属氧化物,两者都能与水反应生成碱
5.[2017·自贡]下列有关实验的描述错误的是( )
A.用肥皂水可区分硬水和蒸馏水
B.稀释浓硫酸时,应将水倒入浓硫酸中
C.用氢氧化钠溶液可以除去一氧化碳中混有的二氧化碳
D.蒸发结晶时,当蒸发皿中出现较多固体可停止加热
6.[2017·临沂]类推是化学学习中常用的思维方法。下列类推正确的是( )
A.活泼金属与酸反应有气体产生,则与酸反应产生气体的—定是活泼金属
B.酸与碱发生中和反应生成盐和水,则生成盐和水的反应一定是中和反应
C.单质一定是由同种元素组成的物质,则由同种元素组成的物质一定是单质
D.碱性溶液能使酚酞溶液变红,则能使酚酞溶液变红的溶液一定是碱性溶液
7.[2017·大庆]化学与人类生产生活息息相关,下列性质与应用不存在因果关系的是( )
A.氢氧化钠能与油脂反应,在生活中可用来除油污
B.活性炭具有吸附性,可用于吸收装修产生的有害气体
C.石墨有金属光泽,可用作干电池的电极
D.熟石灰具有碱性,可用于改良酸性土壤
8.[2017·连云港]下列有关实验现象的描述正确的是( )
A.小木棍蘸取浓硫酸一段时间后,小木棍变黑
B.硝酸铵固体溶于水后,溶液的温度几乎不变
C.氢氧化钠固体久置于表面皿上,无明显现象
D.尿素和熟石灰混合研磨,产生刺激性气味的气体
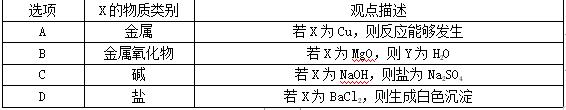
9.[2017·陕西]向盛有一定量氧化铁粉末的烧杯中不断加入稀盐酸,烧杯中相关量的变化与图像相符的是( )
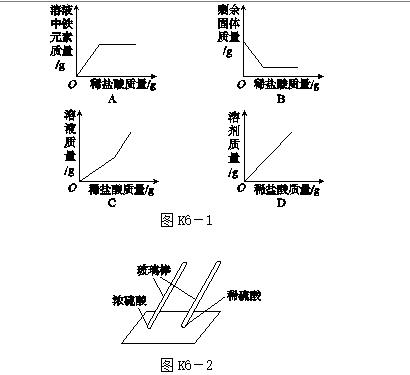
10.[2017·临沂]用玻璃棒蘸硫酸在白纸上写字,如图K6-2所示。
(1)现象:放置一会儿发现用________(填"浓"或"稀")硫酸在白纸上写的字变黑。
(2)结论:同种酸由于__________________不同,它们的性质不完全相同。
11.[2017·临沂]食醋中一般含有3%~5%的醋酸,醋酸又叫乙酸(CH3COOH),是无色有刺激性气味的液体,能溶于水。
(a)食醋可以除去水壶内的水垢,水垢的主要成分之一是碳酸钙。除水垢时,可在水壶中加入水,倒入适量食醋,浸泡一段时间,碳酸钙会转变成可溶性的醋酸钙而被除掉,化学方程式为CaCO3+2CH3COOH===Ca(CH3COO)2+H2O+CO2↑。
(b)在熬制骨头汤时,常常在汤中加入少量食醋,因为骨头中含有不溶于水的磷酸钙,磷酸钙与醋酸反应生成可溶性的磷酸二氢钙,能够增加汤内的含钙量,促进人体对钙、磷的吸收和利用。
(c)食醋不仅在厨房中大显身手,还是一种杀菌剂,冬天在屋子里熬食醋可以杀灭细菌,对预防流感有很大作用。
(d)饮酒过量的人可以用食醋来解酒。因为乙酸能与乙醇发生反应生成乙酸乙酯(CH3COOC2H5)和水,从而达到解酒的目的。
(e)醋酸能与活泼金属发生置换反应产生氢气,家用铝盆等金属制品不能用来盛放食醋,以免被腐蚀。
根据以上内容,回答下列问题。
(1)乙酸属于______________(填"有机化合物"或"无机化合物")。
(2)乙酸的物理性质是______________________________________(任答一条)。
(3)食醋能用来解酒的原因是____________________________________________。
(4)用食醋除水垢,该反应属于基本反应类型中的______________反应。
(5)用铁锅炒菜时,放一点食醋能更好补铁的原因是______________________________。
12.[2017·玉林]某兴趣小组为了区分氢氧化钠溶液和氢氧化钙溶液,设计了如图K6-3所示的四组实验方案,请按要求回答问题。
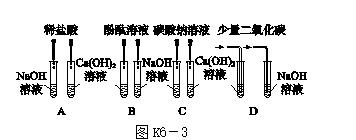
(1)上述实验方案中能达到实验目的的是________(填序号)。
(2)C组实验中发生反应的化学方程式为___________________________________________。
[继续探究] 实验结束后,小组的同学将A、B、C、D四组实验八支试管中的物质倒入同一个烧杯中,最终得到无色透明的溶液。
[分析讨论]
①八支试管中能跟稀盐酸发生化学反应的物质有________种(酚酞除外)。
②最终得到的溶液中:一定含有的溶质是________(填化学式,下同),一定不含有的溶质是__________________________________,可能含有的溶质是________。
[实验验证] 为了验证最终得到的溶液中可能含有的溶质是否存在,小组的同学取少量烧杯中的溶液于试管中,向其中逐滴加入碳酸钠溶液直至过量,观察到________________,证明含有该溶质。
[拓展延伸] 小组的同学把D组实验方案中的二氧化碳换成二氧化硫,达到同样实验效果。二氧化硫跟氢氧化钙反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
13.某化学实验活动小组的同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验,请你参与他们进行的探究活动。
[提出问题] 久置氢氧化钠固体的成分是什么?
[猜想与假设] 猜想1:全部是NaOH;猜想2:全部是Na2CO3;猜想3:是NaOH和Na2CO3的混合物。
[实验与探究] (1)实验如下:

(2)为了进一步验证猜想结果,小明同学提出如下实验方案:继续实验二的实验,过滤,然后向滤液中滴加酚酞溶液,若现象为__________,则猜想3成立;若现象为____________,则猜想2成立。
[反思与评价] (3)实验二中使用的氯化钡溶液不能被氢氧化钡溶液代替的原因是________________________________________________________________________
________________________________________________________________________。
14.化学兴趣小组的同学在帮助老师整理实验室时,意外地发现实验桌上有一瓶敞口放置的氢氧化钙粉末。于是对该粉末进行了如下探究。
[提出问题] 该瓶粉末的成分是什么?
[猜想与假设] 猜想一:该瓶粉末的成分可能为氢氧化钙;
猜想二:该瓶粉末的成分可能为氢氧化钙和碳酸钙;
猜想三:该瓶粉末的成分可能为________,作出猜想三的理由是________________________________________________________________________。
[实验验证] 请你参与探究,完成下面的实验报告。

(2)取步骤(1)中的________于试管中,滴加无色酚酞溶液,______________________________________________
__________________________,说明含有_________________________________________________________________
[联想与启示] 氢氧化钙露置在空气中会发生变质的原因是_________________________________________________
_______________________(用化学方程式表示),因此,必须________保存。
15.化学实验是进行科学探究的重要方式。
Ⅰ.已知:二氧化碳气体既不溶于饱和NaHCO3溶液也不与NaHCO3反应;NaHCO3+HCl === NaCl+H2O+CO2↑。某学生欲用浓盐酸与大理石反应制取干燥、纯净的二氧化碳气体,实验室提供了下列装置和药品。
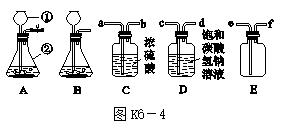
(1)仪器①的名称是____________,仪器②的名称是__________。
(2)实验室制取二氧化碳气体的反应原理是_______________________________________________(用化学方程式表示)。
(3)装置A、B都可作发生装置,其中可控制反应进行的是__________(填序号)。
(4)装置C中浓硫酸的作用是________________________________________________________________________
______________________________________。
(5)两个净化装置相连接时,其仪器接口顺序应为________接________(填接口序号)。
(6)若用装置E收集二氧化碳气体,则气体应从________(填接口序号)口进入。
Ⅱ.兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验,请你与他们一起完成以下探究活动。
[对固体猜想]
猜想1:全部是NaOH;猜想2:全部是Na2CO3;猜想3:是NaOH和Na2CO3混合物。
[实验和推断]
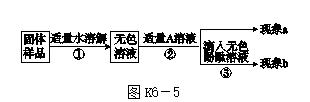
(1)若A是盐酸,现象a为有气泡产生,说明氢氧化钠已经变质。
(2)若A是Ca(OH)2溶液,现象a为有白色沉淀,现象b为无色酚酞溶液变红,该实验________(填"能"或"不能")说明样品中有NaOH。
(3)若A是CaCl2溶液,当实验现象a为______________________,现象b为________________________,则猜想2成立。
[反思] 久置的氢氧化钠变质的原因是____________________________________(用化学方程式表示)。
参考答案
1.C 2.C 3.A 4.A 5.B 6.D 7.C
8.A 9.A
10.(1)浓
(2)浓度或溶质质量分数
11.(1)有机化合物
(2)无色有刺激性气味的液体(或能溶于水)
(3)乙酸能跟乙醇发生反应生成乙酸乙酯和水,从而达到解酒的目的
(4)复分解
(5)醋酸能与铁发生反应生成易被人体吸收的物质(合理即可)
12.(1)C
(2)Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
[分析讨论] ①4 ②NaCl、CaCl2
NaOH、Ca(OH)2、Na2CO3 HCl
[实验验证] 有气泡冒出
[拓展延伸] Ca(OH)2+SO2===CaSO3↓+H2O
[解析] (1)Na2CO3与NaOH不发生反应,与Ca(OH)2反应生成白色沉淀CaCO3。(2)Na2CO3与Ca(OH)2反应生成CaCO3沉淀和NaOH,化学方程式为Ca(OH)2+Na2CO3===CaCO3↓+2NaOH。[分析讨论] ①实验结束后,八支试管中的物质有NaCl、CaCl2、Ca(OH)2、NaOH、Na2CO3、CaCO3,可以与盐酸反应的有Ca(OH)2、NaOH、Na2CO3、CaCO3,共4种。②混合后,最终得到无色透明的溶液说明没有CaCO3,表示CaCO3反应完全,盐酸可能恰好完全反应,也可能过量,盐酸与氢氧化钠反应生成NaCl,与氢氧化钙反应生成CaCl2,所以NaCl、CaCl2肯定存在;因为盐酸可能恰好完全反应,也可能过量,所以NaOH、Ca(OH)2、Na2CO3、CaCO3都不会存在。[实验验证] 盐酸和碳酸钠反应有二氧化碳生成,所以有气泡冒出。[拓展延伸] 类比二氧化碳与氢氧化钙的反应,可推知二氧化硫跟氢氧化钙反应的化学方程式为Ca(OH)2+SO2===CaSO3↓+H2O。
13.(1)1 白色沉淀
BaCl2+Na2CO3===BaCO3↓+2NaCl
(2)滤液变红 滤液不变色
(3)会引入OH-,干扰氢氧化钠的检验
14.[猜想与假设] 碳酸钙 氢氧化钙完全变质
[实验验证] 稀盐酸 碳酸钙 滤液 酚酞溶液变红 氢氧化钙
[联想与启示] Ca(OH)2+CO2===CaCO3↓+H2O 密封
15.Ⅰ.(1)长颈漏斗 锥形瓶
(2)CaCO3+2HCl===CaCl2+H2O+CO2↑
(3)A
(4)干燥二氧化碳气体(或吸收二氧化碳气体中的水蒸气)
(5)d a (6)e
Ⅱ.(2)不能
(3)有白色沉淀产生 无色酚酞不变红
[反思] CO2+2NaOH===Na2CO3+H2O

 加载中,请稍侯......
加载中,请稍侯......
精彩评论