2021年中考化学一轮复习考点讲解(附解析)(文件编号:21040303)
目录:
2021年中考化学一轮复习常见的酸和碱考点讲解(附解析)
2021年中考化学一轮复习化学材料与化学能源考点讲解(附解析)
2021年中考化学一轮复习化学方程式及其计算考点讲解(附解析)
2021年中考化学一轮复习化学式和化合价考点讲解(附解析)
2021年中考化学一轮复习化学与生活考点讲解(附解析)
2021年中考化学一轮复习金属的化学性质考点讲解(附解析)
2021年中考化学一轮复习燃烧与灭火考点讲解(附解析)
2021年中考化学一轮复习认识化学元素考点讲解(附解析)
2021年中考化学一轮复习物质的分类及构成物质的微粒考点讲解(附解析)
2021年中考化学一轮复习物质的检验与鉴别推断和分离与提纯考点讲解(附解析)
2021年中考化学一轮复习盐和化肥考点讲解(附解析)
2021年中考化学一轮复习质量守恒定律考点讲解(附解析)
关注微信公众号:cc518xxzl 可免费领取本资料word完整版!
简介:
常见的酸和碱
一、浓盐酸和浓硫酸的性质
1、浓盐酸:无色,有刺激性气味的液体,有强腐蚀性。工业盐酸因含有杂质而呈黄色。浓盐酸在空气中打开瓶口,会在瓶口处形成白雾,这是因为从浓盐酸中挥发出来的氯化氢跟空气中的水蒸气接触,形成盐酸小液滴缘故,说明浓盐酸具有挥发性。
2、浓硫酸:纯净的浓硫酸是无色、粘稠油状的液体,不易挥发。浓硫酸有较强的吸水性,因而常用作气体干燥剂;浓硫酸有强烈的腐蚀性,因而使用时要特别小心。
3、如果不慎将硫酸或盐酸沾到皮肤上,要立刻用大量水冲洗,然后涂上3%到5%的碳酸氢钠溶液,以防止烧伤皮肤。
4、稀释浓硫酸:一定要把浓硫酸沿器壁慢慢注入水中,并不断用玻璃棒搅拌,切不可将水倒入浓硫酸,原因是防止酸液沸腾溅出伤人。
5、思考:如果把浓盐酸和浓硫酸分别敞口放置空气中,下列情况发生什么变化?
溶质的质量 | 溶剂的质量 | 溶液的质量 | 溶质质量分数 | |
浓盐酸 | 变小 | 不变 | 变小 | 变小 |
浓硫酸 | 不变 | 变大 | 变大 | 变小 |
二、酸的化学性质
酸与酸碱指示剂作用,酸能使紫色石蕊试液变红;使无色酚酞不变色。
酸与活泼金属反应:酸+活泼金属=氢气+盐
(常见:铁、铝、锌、镁是活泼金属;铜、金、银为不活泼金属)
(1)盐酸与镁条反应的现象:放出气体;镁逐渐溶解至消失;放热;溶液由无色逐渐变为浅绿色。反应的方程式:Mg+2HCl=MgCl2+H2↑。
(2)盐酸与铁钉反应:铁钉表面有气泡产生,同时溶液由无色逐渐变成浅绿色。
反应的化学方程式:Fe+2HCl=FeCl2+H2↑。(★单质铁和酸反应时,生成物中铁显+2价,所得溶液是浅绿色。)
酸与金属氧化物反应:酸+金属氧化物=水+盐
(1)盐酸与生锈的铁钉反应的现象:铁锈逐渐溶解至消失;溶液由无色逐渐变为黄色。
方程式Fe2O3+6HCl=2FeCl3+3H2O。(铁锈的主要成分为Fe2O3,含Fe3+的溶液是黄色。)
(2)硫酸与氧化铜反应的现象:黑色氧化铜逐渐溶解至消失;溶液由无色逐渐变为蓝色,方程式:CuO+H2SO4=CuSO4+H2O。
酸与碱反应:酸+碱=水+盐
(1)氢氧化钠和盐酸反应:NaOH+HCl=NaCl+H2O。
(2)用含氢氧化铝的药物治疗胃酸过多:3HCl+Al(OH)3=AlCl3+3H2O。
酸与部分盐反应:
(1)与碳酸盐反应(含碳酸根离子的盐):酸 + 碳酸盐=水+ 二氧化碳 +盐
①石灰石和盐酸的反应的化学方程式:2HCl+CaCO3=CaCl2+H2O+CO2↑。
②碳酸钠和盐酸的反应的化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑。
(2)与其它盐反应:酸 + 盐=另一种酸+另一种盐
①盐酸与硝酸银反应方程式:HCl+AgNO3=AgCl↓+HNO3;现象:生成白色沉淀。
②硫酸与氯化钡反应方程式:H2SO4+BaCl2=BaSO4↓+2HCl;现象:生成白色沉淀。
6、酸有相似的化学性质是因为溶于水都能解离出氢离子;具有差异性是因为酸根离子不同。
三、盐酸和硫酸的用途:
1.工业上稀盐酸和稀硫酸都可以除金属秀。
2.人体胃液中含有盐酸,帮助消化。
3.浓硫酸具有吸水性,在实验室用它做干燥剂,但不能干燥与浓硫酸反应的气体,如氨气。
四、氢氧化钠和氢氧化钙的性质
1、氢氧化钠:纯净的氢氧化钠具有:①白色固体;②易溶于水,溶解时放出热量;③暴露在空气中的氢氧化钠固体容易吸收空气中的水蒸气而逐渐溶解,因此可做干燥剂;④强腐蚀性,故俗称火碱、烧碱、苛性钠;
2、氢氧化钠一定要密封保存是因为:①氢氧化钠在空气中能吸收空气中的水蒸气,②能![]() 跟二氧化碳发生反应而生成碳酸钠。
跟二氧化碳发生反应而生成碳酸钠。
3、氢氧化钙:纯净的氢氧化钙是白色粉末状固体,微溶于水,其水溶液俗称为石灰水。有腐蚀性,是熟石灰、消石灰的主要成分。
4、氢氧化钙的制取:从石灰石到生石灰再到熟石灰:CaCO3  CaO+CO2↑;CaO+H2O=Ca(OH)2
CaO+CO2↑;CaO+H2O=Ca(OH)2
5、如果不慎将强碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液。
五、碱的化学性质
1、碱与酸碱指示剂作用,碱能使紫色石蕊试液变蓝,使无色酚酞试液变红。
2、碱与非金属氧化物反应:碱+非金属氧化物=水+盐
(1)氢氧化钠与二氧化碳反应的方程式:2NaOH+CO2=Na2CO3+H2O。
(2)氢氧化钙与二氧化碳反应的方程式:Ca(OH)2+CO2=CaCO3↓+H2O。
3、碱与酸反应:碱+酸=水+盐
(1)氢氧化钠和盐酸反应:NaOH+HCl=NaCl+H2O。
(2)用含氢氧化铝的药物治疗胃酸过多:3HCl+Al(OH)3=AlCl3+3H2O。
4、碱与部分盐反应:碱+盐=另一种碱+另一种盐
【不溶性碱:氢氧化铜(蓝色沉淀)、氢氧化镁(白色沉淀)】
(1)2NaOH+CuCl2=Cu(OH)2↓+2NaCl现象是生成蓝色沉淀。
(2)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH现象是生成白色沉淀。
(3)Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2 现象是生成白色沉淀。
5、碱有相似的化学性质是因为都能解离出氢氧根离子;具有差异性是因为阳离子不同。
六、氢氧化钠和氢氧化钙的用途:
1.氢氧化钠:(1)氢氧化钠固体可以吸收水蒸气用作干燥剂。
(2)化工原料:造纸、印染、炼油、制造化学纤维、生产橡胶;
2.氢氧化钙:可以改良酸性土壤,检验二氧化碳体存在,处理工业废水中的酸,与蓝矾、水配制杀菌剂波尔多液等。
七、中和反应
1、定义:酸和碱作用生成盐和水的反应。
2、实质:其实质是H+和OH结合生成H2O。
3、温馨提示:中和反应不属于四大基本反应类型,基本反应类型有:①、置换反应;②复分解反应 ③分解反应④化合反应;但是中和反应属于其中的复分解反应。
4、应用:
(1)、用于医药卫生
①、胃酸过多可以服用某些碱性物质的药物,以中和过多的胃酸。胃舒平的主要成分是Al(OH)3,其治疗胃酸的化学方程式3HCl + Al(OH)3 ==AlCl3 + 3H2O。
②、因为铝元素对人体的健康有影响,现在普遍采用Mg(OH)2代替Al(OH)3治疗胃酸过多,反应的化学方程式是2HCl + Mg (OH)2 == MgCl2+ 2H2O。
(2)改变土壤的酸碱性
如:酸性土壤不利于作物的生长,于是人们将适量的熟石灰加入土壤以中和酸性。
(3)处理工厂的废水
如:硫酸厂的污水可以用熟石灰进行中和处理,化学方程式:H2SO4 + Ca(OH)2 == CaSO4+ 2H2O。
调节溶液的酸碱性
八、溶液酸碱度的表示法——pH
1、溶液的pH与酸碱性关系
①、pH=7,溶液呈中性;
②、pH<7,溶液呈酸性,pH越小,酸性越强,即:H+的浓度越高酸性越强;
③、pH>7,溶液呈碱性,pH越大,碱性越强,即:OH-的浓度越高碱性越强。
pH值:1 2 3 4 5 6 7 8 9 10 11 12 13 14

![]() 酸性增强 中性 碱性增强
酸性增强 中性 碱性增强
2、pH的测定:最简单的方法是使用pH试纸
(1)①在洁净干燥的玻璃片或白瓷板上放一片pH试纸;②用洁净干燥的玻璃棒蘸取待测试液;③滴在pH试纸(试纸不能预先用水润湿)上,④立即将试纸显示的颜色与标准比色卡对照,⑤便可读出溶液的pH(注意:读数精确到整数。(简记为:放、蘸、滴、对、读)
(2)pH试纸不能用水预先润湿否则,若溶液是酸性的则酸性减弱pH会偏大;若溶液是碱性的则碱性减弱pH会偏小;若溶液是中性则没有影响pH不变。
3、酸碱性与酸碱度关系:
指示剂 | pH值 | 石蕊 | 酚酞 |
酸性 | <7 | 变红色 | 无色 |
中性 | =7 | 紫色 | 无色 |
碱性 | ﹥7 | 变蓝色 | 变红色 |

题型一 酸
【经典例题】【2018江苏苏州】下列关于浓硫酸的说法正确的是( )
A.易挥发 B.有腐蚀性 C.无吸水性 D.密度比水小
【答案】B
【解析】浓硫酸具有吸水性、腐蚀性、不挥发,密度比水大,溶解放热的性质,故选择B。
【点睛】解题时根据浓硫酸的性质来分析解答,难度不大。
【经典例题】【2019四川泸州】下列物质不能与盐酸反应的是( )
A.Mg B.AgNO3 C.Cu( OH)2 D.FeSO4
【答案】D
【解析】A、Mg能与盐酸反应生成氯化镁溶液和氢气,故选项错误。
B、AgNO3能与盐酸反应氯化银沉淀和硝酸,故选项错误。
C、Cu( OH)2能与盐酸反应生成氯化铜和水,故选项错误。
D、FeSO4与盐酸不反应,故选项正确。
故选:D。
【点睛】本题难度不大,掌握酸的化学性质(能与活泼金属、金属氧化物、碱、碳酸盐等反应)并能灵活运用是正确解答本题的关键。
【趁热打铁】
1、【2019广东省茂名一模】下列有关酸的说法中,正确的是( )
A.酸的组成中一定含有氢元素 B.能够导电的溶液是酸
C.滴加无色酚酞不变色的溶液是酸 D.能与碱发生反应的物质是酸
【答案】A
【解析】A.电离时,产生的阳离子全部是氢离子的化合物属于酸,所以酸中一定含有氢元素,故正确;
B.酸、碱、盐的水溶液都具有导电性,能导电的不一定是酸,故错误;
C.酸性溶液与中性溶液均不能使无色酚酞试液变色,故错误;
D.部分非金属氧化物也能与碱反应,如二氧化碳与氢氧化钠反应生成碳酸钠和水,故错误。
故选A。
2、【2019四川攀枝花】厕所用清洁剂中含有盐酸,如果不慎洒到大理石地面上,会发出嘶嘶声,并有气体产生。这种气体是( )
A.二氧化碳 B.氧气 C.氢气 D.二氧化硫
【答案】A
【解析】稀盐酸和大理石中的碳酸钙反应生成的气体是二氧化碳。
故选:A。
3、【2019甘肃天水】为探究盐酸的化学性质,某化学小组做了如下实验:
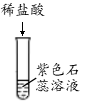
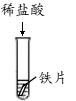
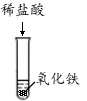
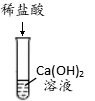

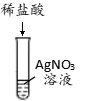
A B C D E F
(1)上述反应中无现象的为 (填字母序号,下同),有白色沉淀出现的是 ;B试管中所发生反应的化学方程式为 。
(2)将反应后D和E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。
【提出问题】滤液中溶质的成分是什么?
【假设与猜想】猜想一:NaC;猜想二:NaCl和CaCl2;猜想三:NaCl、Ca(OH)2和HCl;猜想四: 。
【讨论与交流】经讨论,同学们一致认为猜想 是错误的。
【实验与结论】
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量碳酸钠溶液 | 无现象 | 猜想四成立 |
取少量滤液于试管中,滴加适量 |
【拓展与迁移】稀盐酸和稀硫酸有相似的化学性质,是因为它们的溶液中都存在 。
【答案】(1)D、F、Fe+2HCl===FeCl2+H2↑;(2)【假设与猜想】NaCl和Na2CO3 【讨论与交流】三【实验与结论】稀盐酸(或氯化钙溶液或氯化钡溶液)、有气泡产生(或有白色沉淀产生)(合理即可)。
【拓展与迁移】H+(或氢离子)
【解析】(1)A中紫色石蕊变红,B中有气泡产生,C中红色固体溶解,溶液由无色变成黄色,D中反应中和反应,现象不明显,E中有气泡产生,F中有白色沉淀生成,即上述反应中无现象的为D,有白色沉淀出现的是F;B试管中所发生反应的化学方程式:Fe+2HCl===FeCl2+H2↑;(2)D和E中发生反应方程式:2HCl+Ca(OH)2=CaCl2+2H2O,2HCl+Na2CO3=2NaCl+H2O+CO2↑;【假设与猜想】猜想四为NaCl和Na2CO3;【讨论与交流】Ca(OH)2和HCl可以反应,不能共存,猜想三错误;【实验与结论】滴加适量稀盐酸(或氯化钙溶液或氯化钡溶液),有气泡产生(或有白色沉淀产生),即可判断猜想四正确;【拓展与迁移】稀盐酸和稀硫酸溶液中都含有H+(或氢离子),具有相似的化学性质。
题型二 碱
【经典例题】【2018广西北部湾经济开发区】下列有关氢氧化钠的说法,错误的是( )
A.氢氧化钠俗称烧碱
B.氢氧化钠有强烈的腐蚀性
C.氢氧化钠固体可用于干燥二氧化碳气体
D.氢氧化钠可用于制肥皂、洗涤剂、造纸、纺织工业等
【答案】C
【解析】A、氢氧化钠俗称烧碱、火碱、苛性钠,故选项说法正确。
B、氢氧化钠具有强烈的腐蚀性,故选项说法正确。
C、氢氧化钠能与二氧化碳反应生成碳酸钠和水,不能用来干燥二氧化碳气体,故选项说法错误。
D、氢氧化钠是一种重要的化工基础原料,广泛地应用于制肥皂、洗涤剂、造纸、纺织工业,故选项说法正确。
故选C。
【点睛】本题难度不大,掌握氢氧化钠的化学性质、物理性质、用途是正确解答本题的关键。
【经典例题】【2019辽宁葫芦岛】为了探究碱的化学性质,同学们进行了如图所示的实验。
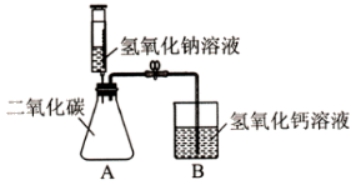
【实验操作】
夹紧弹簧夹,将注射器中的氢氧化钠溶液全部注入锥形瓶中。锥形瓶中发生反应的化学方程式为 。反应一段时间后,打开弹簧夹,观察到的现象为 ,锥形瓶底部有白色沉淀生成。
【废液处理】
(1)将反应后锥形瓶内的物质全部倒入烧杯B中,然后滴入几滴无色酚酞溶液,充分混合后,烧杯内的液体为 色。
(2)再向烧杯中倒入一定量的稀盐酸,充分反应后,烧杯内得到无色澄清溶液,则该无色溶液中一定含有的溶质是 。请写出该烧杯内发生中和反应的化学方程式 (写一个)。
(3)最后烧杯内的无色溶液能否直接排放,请阐述你的观点并说明理由 。
【反思交流】上述实验活动验证了碱可以与某些物质发生化学反应。
【答案】【实验操作】2NaOH+CO2=Na2CO3+H2O;烧杯中的石灰水进入锥形瓶内;
【废液处理】
(1)红;NaOH+HCl=NaCl+H2O【或Ca(OH)2+2HCl=CaCl2+H2O】;
(2)氯化钙和氯化钠;
(3)不能,该溶液可能为酸性溶液会产生污染。
【解析】【实验操作】
二氧化碳和氢氧化钠反应生成碳酸钠和水,化学方程式为:2NaOH+CO2=Na2CO3+H2O;二氧化碳被氢氧化钠溶液吸收,使锥形瓶内气体压强减少,在外界大气压的作用下烧杯中的石灰水进入锥形瓶内;碳酸钠和氢氧化钙反应生成碳酸钙白色沉淀和氢氧化钠;
【废液处理】
(1)因为烧杯内的液体显碱性,所以滴入几滴无色酚酞溶液,充分混合后液体显红色;
(2)再向烧杯中倒入一定量的稀盐酸,充分反应后,烧杯内得到无色澄清溶液,其中的反应可能有:氢氧化钠和盐酸反应生成氯化钠和水;氢氧化钙和盐酸反应生成氯化钙和水;碳酸钙和盐酸反应生成氯化钙、水和二氧化碳;碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,所以则该无色溶液中一定含有的溶质是氯化钙和氯化钠;该烧杯内发生中和反应的化学方程式有:NaOH+HCl=NaCl+H2O【或Ca(OH)2+2HCl=CaCl2+H2O】;
(3)溶液不中性的时候不能直接排放可能会污染水源。所以最后烧杯内的无色溶液不能直接排放,该溶液可能为酸性溶液会产生污染。
【点睛】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论
【趁热打铁】
1、【2018广州市】下列物质属于碱的是( )
A. H2O B. NaHCO3 C.Ca(OH)2 D.H3BO3
【答案】C
【解析】碱是由金属离子和氢氧根离子构成的,A为氧化物,B属于盐,C属于碱,D是酸,故选C。
2、【2019山东临沂】下列物质存放在烧杯中一段时间后,质量变小且不变质的是( )
A.烧碱 B.浓硫酸 C.浓盐酸 D.生石灰
【答案】C
【解析】A、烧碱能与二氧化碳反应生成碳酸钠而变质,质量增大,故不符合;
B、浓硫酸具有吸水性,能吸收空气中的水而使质量增大,发生的是物理变化,物质不变质,故不符合;
C、浓盐酸具有挥发性,易挥发出溶质氯化氢而导致溶液质量减少,不变质,故符合;
D、生石灰吸收空气中的水蒸气生成氢氧化钙,质量增加,故不符合,
故选:C。
3、【2017吉林省】根据碱的四条化学性质回答下列问题:
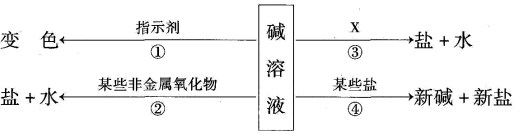
(1)碱溶液能使酚酞溶液变______色;
(2)图中的X代表一类物质,则X为__

(3)碱溶液有相似化学性质的原因是都含有__________。
【答案】(1)红;
(2)酸,NaOH+HCl=NaCl+H2O;
(3)氢氧根离子
【解析】(1)碱能使无色酚酞变红色;
(2)氢氧化钠是一种碱,能与酸碱指示剂、某些非金属氧化物、酸和某些盐反应,所以X应是酸,盐酸和氢氧化钠反应生成氯化钠和水,化学方程式为:NaOH+HCl=NaCl+H2O;
(3)碱溶液有相似化学性质的原因是都含有氢氧根离子。
题型三 中和反应
【经典例题】【2018广西梧州】某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如右图所示。下列说法错误的是( )
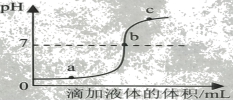
A.图中b点所示溶液中,溶质是NaCl
B.向图中c点所示溶液中滴加无色酚酞,溶液不变色
C.该实验是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧杯中
D.由a点到b点的pH变化过程证明酸和碱发生了中和反应
【答案】B
【解析】根据图中信息可知溶液pH值越来越大,该实验是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧杯中;图中b点所示溶液pH=7,酸碱完全反应,溶液中溶质是NaCl;图中c点所示溶液pH>7,显碱性,滴加无色酚酞,溶液变红色;由a点到b点的pH变化过程证明酸和碱发生了中和反应。故选B。
【点睛】本题难度不大,掌握中和反应的原理、反应的实质、氢氧化钠和盐酸量的多少,是正确解答本题的关键。
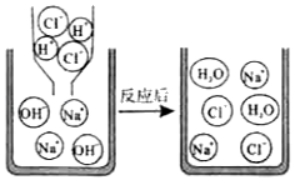
【经典例题】【2019.河南】如图是氢氧化钠与盐酸反应示意图。
(1)反应前后没有发生变化的离子有哪些?
(2)用实际参加反应的离子符号来表示反应的式子叫做离子方程式。请写出氢氧化钠与盐酸反应的离子方程式。
【答案】(1)钠离子和氯离子;
(2)H++OH﹣═H2O。
【解析】(1)由氢氧化钠与盐酸反应示意图,反应前后没有发生变化的离子是钠离子和氯离子。
(2)氢氧化钠与盐酸反应生成氯化钠和水,实际参加反应的离子是氢离子和氢氧根离子,生成水分子,反应的离子方程式为:H++OH﹣═H2O。
【点睛】本题难度不大,掌握中和反应的原理、反应的实质(氢离子结合氢氧根离子生成水分子)是正确解答本题的关键。
【趁热打铁】
1、【2019广西来宾一模】下列做法利用了酸碱中和反应原理的是( )
A.用食醋腌木瓜放入食盐进行调味 B.用稀盐酸除去铁钉上的铁锈
C.焙制蛋糕时加入碳酸氢钠使蛋糕膨松 D.服用含氢氧化铝的药物治疗胃酸过多症
【答案】D
【解析】A、用食醋腌木瓜放入食盐进行调味,没有发生酸与碱生成盐和水的反应,没有运用中和反应原理,故选项错误;
B、铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,是利用了酸能与金属氧化物反应生成盐和水,没有运用中和反应原理,故选项错误;
C、焙制蛋糕时加入碳酸氢钠使蛋糕膨松,主要是利用了碳酸氢钠受热生成碳酸钠、水和二氧化碳,没有运用中和反应原理,故选项错误;
D、Al(OH)3与胃酸中的盐酸反应生成氯化铝和水,是酸和碱的反应,是利用了中和反应原理,故选项正确。故选D。
2、【2019贵州省黔东南一模】某校化学小组在利用硫酸和氢氧化钾溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象如图所示.下列说法正确的是( )
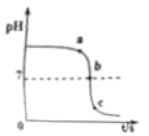
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是K2SO4和H2SO4
C.该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸的烧杯中
D.由b点到c点的变化过程中没有发生化学反应
【答案】D
【解析】A、c点时溶液的pH小于7,显酸性,故选项说法错误;
B、a点时溶液的pH大于7,显碱性,图中a点所示溶液中,含有的溶质是K2SO4和KOH,故选项说法错误;
C、由图象可知,pH值是开始时大于7逐渐的减小到7然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把硫酸滴加到氢氧化钾溶液中,故选项说法错误;
D、由b点到c点的变化过程中,是恰好完全反应后继续滴加稀硫酸,变化过程中没有发生化学反应,故选项说法正确;
故选D。
3、【2019黑龙江绥化】酸、碱、盐在生产、生活中有广泛的应用。
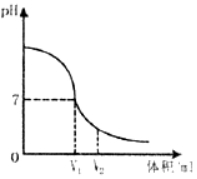
(1)氢氧化钠溶液与稀硫酸反应时,溶液p变化如图所示。
①根据图示判断该实验是将______滴入到______中。
②滴入溶液体积为V2mL时,溶液中溶质为______(填化学式)。
(2)测定某酸溶液pH时,如果放pH试纸的玻璃片上的水没有擦干就进行测定,会使测得的pH______(填“偏大”或“偏小”)(3)用来改良酸性土壤的碱是______。
【答案】(1)①稀硫酸;氢氧化钠溶液;②H2SO4、Na2SO4; (2)偏大; (3)氢氧化钙。
【解析】(1)①由图象可知,PH值是开始时大于7逐渐的减小到7然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使PH减小,说明是把稀盐酸滴加到氢氧化钠溶液中。 ②滴入溶液体积为V2ML时,溶液的PH小于7,溶液显酸性,说明稀硫酸过量,所得溶液中的溶质为H2SO4、Na2SO4。 (2)测定某酸溶液PH时,如果放PH试纸的玻璃片上的水没有擦干就进行测定,稀释了待测溶液,使溶液的酸性减弱,会使测得的PH偏大。 (3)氢氧化钙具有碱性,是用来改良酸性土壤的碱是氢氧化钙。
题型四 溶液酸碱性
【经典例题】【2019山东临沂】人体内一些液体的正常pH范围如下:
液体 | 胃液 | 唾液 | 胆汁 | 胰液 |
pH | 0.9﹣1.5 | 6.6﹣7.1 | 7.1﹣7.3 | 7.5﹣8.0 |
下列说法中不正确的是( )
A.胆汁和胰液显碱性
B.胃液比唾液酸性弱
C.胰液比胆汁碱性强
D.服用含氢氧化铝[Al(OH3)]的药物可以治疗胃酸过多症
【答案】B
【解析】A、胆汁、胰液的pH均大于7,均显碱性,故选项说法正确。
B、胃液的pH比唾液的小,胃液比唾液酸性强,故选项说法错误。
C、胰液的pH比胆汁的大,胰液比胆汁碱性强,故选项说法正确。
D、氢氧化铝能与胃酸发生中和反应,且无毒、无害,服用含氢氧化铝[Al(OH3)]的药物可以治疗胃酸过多症,故选项说法正确。
故选:B。
【点睛】本题难度不大,掌握溶液的酸碱性和溶液pH大小之间的关系是正确解答此类题的关键。
【趁热打铁】
1、【2019湖南郴州】下列溶液能使紫色石蕊溶液变成蓝色的是( )
A.澄清石灰水 B.NaCl溶液 C.稀硫酸 D.KNO3溶液
【答案】A
【解析】A、澄清石灰水显碱性,能使紫色石蕊溶液变成蓝色,故选项正确。
B、氯化钠溶液显中性,不能使紫色石蕊溶液变色,故选项错误。
C、稀硫酸显酸性,能使紫色石蕊溶液变红色,故选项错误。
D、硝酸钾溶液显中性,不能使紫色石蕊溶液变色,故选项错误。
故选:A。
2、【2019湖南邵阳】下列食物的pH如下:果汁(2.9~3.3)、葡萄汁(3.5~4.5)、牛奶(6.3-6.6)、鸡蛋清(7.6~8.0)。其中胃酸过多的人最适合吃( )
A.牛奶 B.鸡蛋清 C.葡萄汁 D.苹果汁
【答案】B
【解析】胃酸过多的人适合吃一些碱性食物,中和过多胃酸 故:B。
3、【2019山东省济南一模】某同学用洁净干燥的玻璃棒蘸取盐酸滴在湿润的pH试纸上,测得pH=3,他判断这是一种酸性溶液,对他的操作方法、测量结果及结论的评价,正确的是( )
A.方法正确,测量结果正确,结论正确 B.方法错误,测量结果偏小,结论正确
C.方法错误,测量结果偏大,结论错误 D.方法错误,测量结果偏大,结论正确
【答案】D
【解析】用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH,某同学用洁净干燥的玻璃棒蘸取盐酸滴在湿润的pH试纸上,稀释了待测溶液,当溶液的pH小于7时,呈酸性,且pH越小,酸性越强,则使溶液的酸性减弱,测定结果偏大,但结论正确。
A、方法错误,测量结果偏大,结论正确,故选项错误;
B、方法错误,测量结果偏大,结论正确,故选项错误;
C、方法错误,测量结果偏大,结论正确,故选项错误;
D、方法错误,测量结果偏大,结论正确,故选项正确;
故选D;
 加载中,请稍侯......
加载中,请稍侯......
精彩评论