初中化学中考考点归纳
考点1:物质的变化、性质、反应类型
(1)判别物理变化还是化学变化的依据是:有无新物质生成。发光、放热、爆炸既可能是化学变化也可能是物理变化。
(2)物质的色、态、味、熔点、沸点、硬度、密度、溶解度属于物理性质,在化学变化中才体现出来的性质属于化学性质(如可燃性、氧化性、还原性、酸碱性等)。
(3)四种基本反应类型是:
化合(A+B→AB)、分解(AB→A+B)、置换(C+AB→AC+B)、复分解(AB+CD→AD+CB)
氧化还原反应中有关概念的关系
得氧——氧化——还原剂(C、CO、H2等);失氧——还原——氧化剂(02、CuO、Fe203等)。
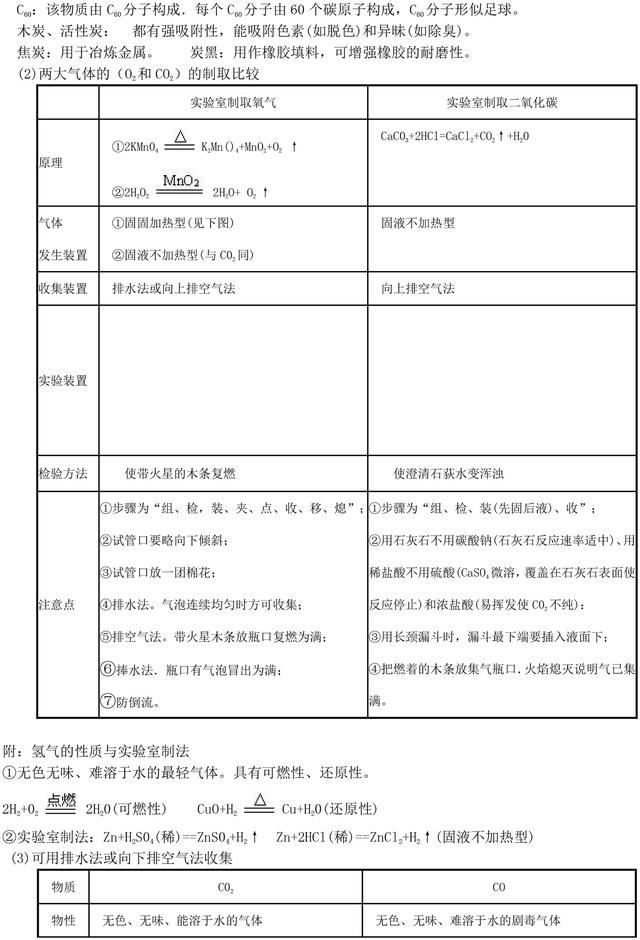
考点2:空气的成分、应用、污染和防治
(1)空气成分及体积分数:N278% 022l%、稀有气体0.94%、C02 0.03%其他杂质气体0.03%
(2)应用:氧气(供给呼吸、支持燃烧)、氮气(作保护气等)、稀有气体(作保护气或电光源来产生各种色光,如氖气一一红色光)
(3)污染大气的物质是可吸入颗粒(如沙尘)和有害气体(主要是CO、N02、S02),大气污染引发三大环境问题一一温室效应(C02,但C02不是大气污染物)、酸雨(S02)、臭气空洞(氟氯代烃,即氟里昂)
(4)三大化石燃料一一天然气、石油、煤(燃烧都会产生C02,石油在驱动汽车、飞机时尾气中有氮氧化物,煤燃烧会产生S02)。氢气是最理想的燃料(取之于水来源丰富、等量燃烧放出热量最大、燃烧产物是水没有污染)但现有技术条件下成本较大。改善能源结构(如开发氢能源、用酒精代替汽油、西气东输用天然气代替煤气等)、控制有害气体的排放等能有效防治气体污染。
考点3:氧气的性质、制法、用途
(1)无色无味气体、不易溶于水,降温可变为淡蓝色液体,甚至变为淡蓝色雪化状同体,氧气通常贮存在蓝色钢瓶中。化学性质见下表。
物质 | 主 要 现 象 | 化学方程式 |
碳 | 剧烈燃烧、发出自光、放热、生成无色无味能使澄清石灰水变浑浊的气体 | C + O2点燃 CO2 |
硫 | 发出蓝紫色火焰;空气中淡蓝色火焰、放热、生成无色有刺激性气味的气体 | S + O2点燃SO2 |
磷 | 发出自光、放热、生成自烟 | 4P + 5O2点燃2P2O5 |
铁 | 剧烈燃烧、火星四射、放热、生成黑色固体 | 3Fe + 2O2点燃Fe3O4 |
铝 | 剧烈燃烧、发出耀眼白光、放出大量的热、生成白色固体 | 4Al + 3O2点燃2Al2O3 |
镁 | 剧烈燃烧、发出耀眼白光、放出大量的热、生成白色固体(空气中即可燃烧) | 2Mg + O2点燃2MgO |
(2)实验室两种制法:
2KMnO4 加热K2MnO4 + MnO2 + O2↑(固固加热型)(组、检、装、夹、点、收、移、熄)
2H2O2 Mn02 催化 H2O+ O2 ↑ (固液不加热型)(Mn02作催化剂“一变两不变”)
可用排水法(不易溶于水)或向上捧空气法(密度比空气大,32>29)收集
工业上用分离液态空气的方法得到氧气(氧气的沸点比氮气高.物理变化)。
(3)用途:供给呼吸、支持燃烧
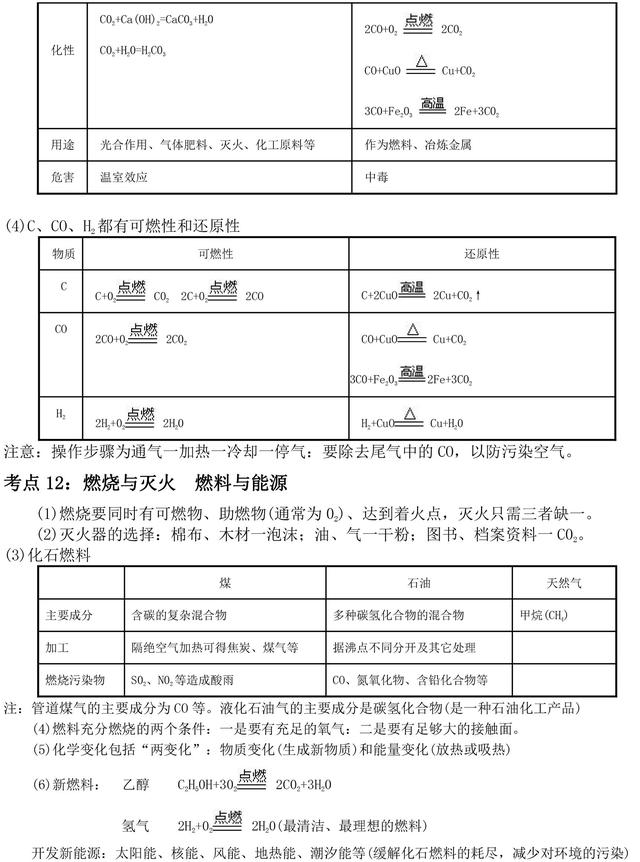
考点4:燃烧、缓慢氧化、自燃和爆炸
燃烧一一即剧烈氧化(在有限空间内的急速燃烧会引起爆炸) 氧化
缓慢氧化(可能引发自燃)
燃烧三条件(缺一不可)一一可燃物、助燃物(通常为氧气)、达到着火点
灭火只需去掉一个条件(三缺一)即可。要记住一些消防安全标志。
考点5:物质的组成与构成,原子核外电子排布
(1)宏观上,物质由元素组成(可由一种元素组成单质,也可由多种元素组成化合物)。元素是核电荷数相同(即质子数相同)、中子数不同的一类原子的总称。核电荷数决定元素的种类。
(2)原子中有:原子序数=核电荷数=质子数=核外电子数:相对原子质量≈质子数+中子数
(3)核外电子分层排布规律:第一层最多只能排2个电子:第二层最多只能排8个电子:最外不能超过8个电子。【要求会书写1-18号元素的原子(离子)结构示意图】
(4)元素的化学性质、种别主要决定于原子的最外层电子数,关系如下:
最外层电子敛 | 元素的性质(原子的性质与元素的化合价) | 元素的种别 |
少于4个 | 原子易失去电子形成阳离子.所带正电荷数:最外层电子数 | 金属元素 |
等于4个 | 不容易得电子,也不容易失电子 | C、Si等 |
多于4个少于8个 | 原子易得到电子形成阴离子.所带负电荷数=(8-最外层电子数) | 非金属元素 |
等于8个 | 稳定结构 | 稀有气体元素 |
一般地,原子的最外层电子数相同化学性质相似。但有例外,如He与Mg。
(5)微观上,物质由原子、分子或离子构成。物质构成的规律如下:
物质类型 | 构成物质的徽粒 | 实 例 |
金属、极少数非金属单质及其化合物 | 原子 | Mg、Hg、(C、Si、SiO2)等 |
绝大多数非金属单质及其化合物 | 分子 | N2、02、H2、Cl2、H20、HCl、NH3、CO2、H2SO4等 |
金属与非金属形成的化合物 | 离子 | NaCl、MgCl2、KCl、Na2S、NaOH等 |
若某物质是由分子(原子)构成的,那么分子(原子)是保持该物质化学性质的最小微粒:化学变化的本质是分子分裂成原子.原子不再分裂.原子之间重新组合成新的分子,因而原子是化学变化中的最小微粒(化学变化:宏观上物质种类变、元素不变:微观上分子种类变、原子不变)。
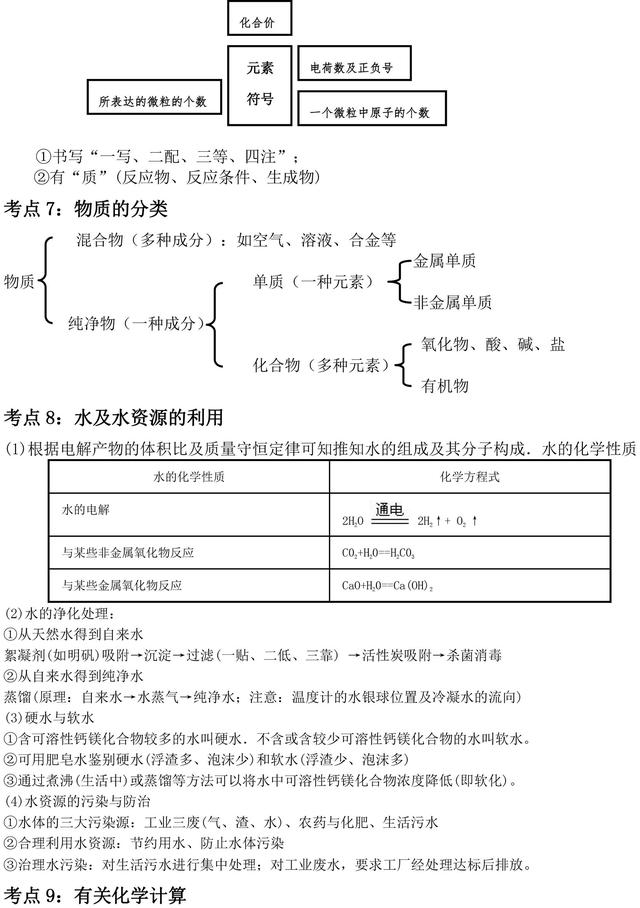
考点6:化学用语的正确书写及其意义
(J)元素符号:①书写“一大二小”:②两(或三)重意义一一元素、一个原子(还可能表示某种单质)。
(2)化学式:①书写
单质一一金属、固态非金属、稀有气体用元素符号表示(他们的化学式与元素符号相同)
化合物一一要借助化合价来书写,“左正右负、标价交叉、化简检验”(或用最小公倍数法)
常见化合价口决:
“一价钾钠氯氢银、二价氧钙钡镁锌、三铝四硅五价磷、二三铁、二四碳、铜汞二价最常见,单质一律为零价”
“负一氢氧硝酸根、负二硫酸碳酸根、还有负三磷酸根、只有正一是铵根”
注意:离子与化合价的表示方法有“一同”(数值相同)“两不同”(位置不同、数值及正负号顺序不同)。
②意义:有三重或四重意义一一宏观物质与宏观组成、微观粒子与微观构成。(由分子构成的物质其化学式有四重意义,其它情况只有三种意义)
归纳:元素符号各方位数字的意义

考点13:金属
(1)金属的化学性质:
①与氧气反应:Mg、Al常温下能与氧气反应表面形成致密氧化膜,有较强的抗腐蚀性;
Fe、Cu在加热时能与氧气反应;Au不与氧气反应,即“真金不怕火炼”。
②与酸(盐酸、稀硫酸等)反应:金属活动顺序H之前的金属与酸发生置换反应生成氢气。(图象:快慢看斜率、多少看高低)
③与化合物溶液反应:金属与化合物溶液发生置换反应遵循金属活动“前置后”的顺序。
(2)合金:金属与金属或非金属的共熔体。属混合物。与各组成物比.合金的硬度更人、强度更好、因而用途更广,但熔点更低。
(3)金属的冶炼:大多数金属氧化物(如CuO、Fe203)都可被C、CO、H2还原成单质。
(4)铁生锈的条件:同时接触氧气和水。(保持干燥、隔绝空气、涂上或镀上保护层等可防生锈)
考点14:溶液
1.溶质的分子或离子分散到溶剂中形成溶液,具有均一性和稳定性;不溶于水的固体小颗粒(或小油滴)经振荡暂时分散到水中形成悬浊液(或乳浊液),浊液不均一、不稳定。
2.溶解是溶质的分子或离子分散到溶剂中的过程,包括分子或离子向水中扩散的吸热过程和分子或离子与水分子水合的放热过程。记住NaOH固体、浓H2SO4溶于水,CaO与水反应放热,NH4NO3固体溶于水吸热。乳化是油脂在乳化剂(如洗涤剂)作用分解成小油滴进入到水中的过程。
3.一定温度下,往一定量的水中加入某溶质,当所得溶液不能再溶解更多的该溶质时,此时的溶液称为该溶质的饱和溶液;反之,则为该溶质的不饱和溶液。饱和溶液与不饱和溶液之间可以相互转化,饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液。
4.一定温度下,l00克水最多所能溶解的固体质量,叫该物质的溶解度。绝大数固体的溶解度随温度的升高而增大,KNO3的S受T影响大,而NaCl的s受T影响小,可通过结晶、重结晶提纯混有少量NaCl的KNO3。Ca(OH)2的S随T的升高而降低。注意溶解度曲线的意义。
5.一定温度、一定压强下,1体积的水最多溶解的气体的体积即为该气体的溶解度。气体的溶解度随温度的升高而减小、随压强的增大在增大。
6.溶质的质量分数=(溶质的质量/溶液的质量)×l00%.溶液的质量=溶质的质量+溶剂的质量=溶液的密度×溶液的体积。
7.溶质的质量分数是表示溶液浓度大小的量.表示100克溶液中溶解了多少克的溶质;溶解度是表示物质溶解能力大小的量。表示某温度下,l00克溶剂最多能溶解多少克的溶质。前者的计算式为:溶质的质量分数= (溶质的质量/溶液的质量)×100%,后者的计算式为:S=(溶质的质量/溶剂的质量)×100g。饱和溶液中,溶质的质量分数=fs/(100g+s)】×100%。
8.一定质量分数溶液的配制:计算(据“溶质的质量守恒”计算溶质的质量或体积、溶剂的体积)——称量(固体阁天平称、液体用量筒量)——溶解(烧杯与玻璃棒)。
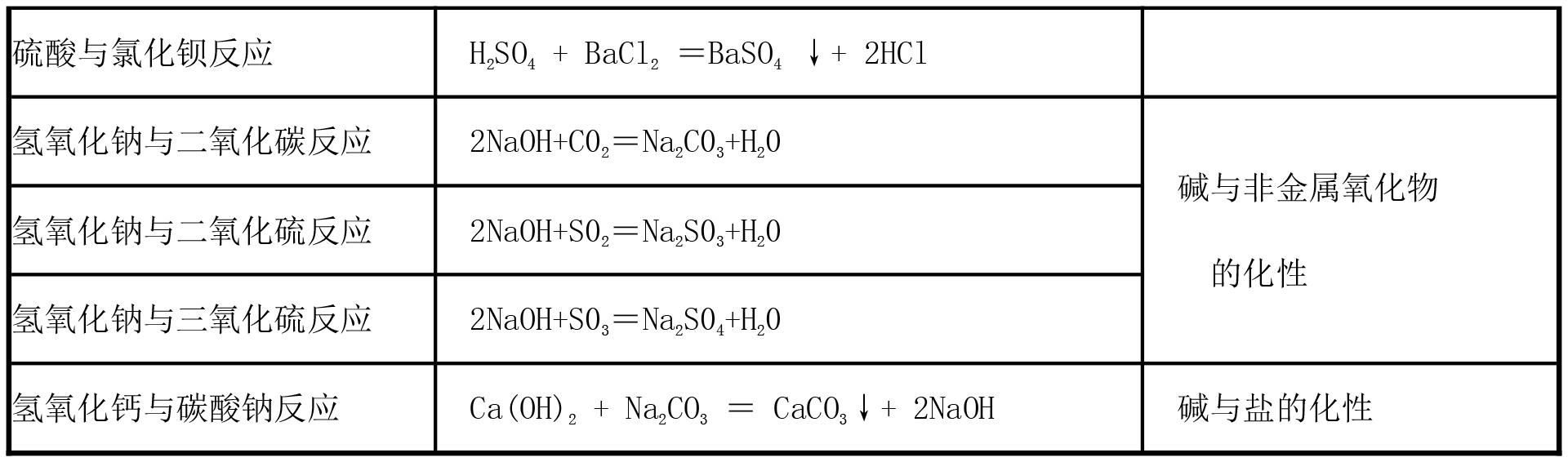
考点15:酸、碱、盐、氧化物的性质
I.酸和碱的化学性质
性质 | 酸(五条) | 碱(四条) | 备注 |
与指示剂的 作用 | 酚酞:无色;石蕊:红色 | 酚酞:红色;石蕊:蓝色 | |
与活泼金属 反应 | H2S04+Zn=ZnS04+H2↑ | 一般无此性质 | 也是金属化性 |
与氧化物的 反应 | 6HCl+Fe203=2FeCl3+3H20 | 2NaOH+C02=Na2CO3+H20 | 也是氧化物化性 |
中和反应 | HCl+NaOH=NaCl+H20 | 是酸碱的共性 | |
与盐的反应 | 2HCl+Na2CO3=2NaCl4+C02↑+H20 | 2NaOH+CuS04=Cu(OH)2↓+Na2SO | 也是盐的化性 |
2.盐的化学性质(四条):
(1)盐+金属=新盐+新金属,在这类反应中.盐一般要能溶于水.反应物金属单质要比盐中的金属活泼。例如:Fe+CuS04=FeSO4+Cu
(2)盐+碱=新盐+新碱.在这类反应中,反应物一般都要能溶于水。
例如:Na2CO3+Ca(OH)2=2NaOH+CaC03↓
(3)盐+酸==新盐+新酸,在这类反应中.强酸(盐酸、硝酸、稀硫酸)一般可以跟弱酸盐(不管是否可溶)反应,即强酸制弱酸;或反应物都溶于水,生成物之一是不溶于酸的沉淀。
例如:CaC03+2HCl=CaCl2+H20+C02↑. BaCl2+H2S04=BaS04↓+2HCl
(4)盐1+盐2=新盐1+新盐2,一般盐需都溶,例如:BaCl2+Na2S04=BaS04↓+2NaCl
3.化肥:大部分属于盐,分成氮肥、磷肥、钾肥三种,含N、P、K中两种或两种以上元素的化肥叫复合肥(如KN03)。化肥和农药的使用大大提高了粮食产量,但使用不当会造成环境污染。
·酸、碱、盐、氧化物的化学性质的简化记忆:“抓住酸碱、适当补充”。
(1)酸碱的性质中已包含了“盐+酸”、“盐+碱”反应的性质,盐的化学性质只需增加“盐+盐”、“盐+金属”即可;
(2)酸碱的性质中已包含了“氧化物+酸”、“氧化物+碱”反应的性质,氧化物的化学性质只需增加“氧化物+水”即可。
4.物质的溶解性规律(限初中):
酸:都可溶: 碱:KOH、NaOH、Ba(OH)2可溶:Ca(OH)2微溶;其它不溶。
盐:钾钠铵盐硝酸盐——全可溶;
盐酸盐(除AgCl↓)硫酸盐(除BaSO4↓)——大多可溶;
碳酸盐【除K、Na、NH4可溶】——大多不溶。
5.溶液的酸碱度可用pH表示,pH=7中性、pH<7酸性、pH>7碱性,pH越小酸性越强、pH越大碱性越强。溶液的pH可用pH试纸测定,步骤为“放、滴、比、读”,pH试纸不可先润湿。
6.浓硫酸与氢氧化钠固体都有强吸水性、强腐蚀性、溶于水都放出大量的热。浓盐酸有挥发性。
附,初中化学中,常见物质的颜色
颜色 | 物质 | 颜色 | 物质 |
黑色 | Mn02、CuO、C、Fe304、 | 红色 | Cu(红)、红磷(暗红)、Fe(OH)3(红褐)、HgO、 Fe203(红棕)、NO2(红棕)、石蕊试液(紫色) |
蓝色 | CuS04•5H2O、Cu(OH)2、 CuSO4溶液、液态02(淡蓝) | 绿色 | Fe2+溶液(浅绿) |
黄色 | S、Fe3+溶液(棕黄) | 难溶白 色固体 | CaCO3、BaSO4、AgCl、Mg(OH)2 BaSO4和AgCl同时还不溶于盐酸、稀硝酸 |
考点16:化学与生活
1.人类的六种营养素:蛋白质(构成细胞的基础物质)、糖类(主要的供能物质)、油脂(重要的供能物质)、维生素(调节新陈代谢、预防疾病、维持身体健康)、水、无机盐。
2.化学元素与人体健康:构成人体的元素有50多种。分常量元素(0、C、H、N、Ca、Na等)、微量元素(又分必需元素,如Fe、I、Zn、Se等,非必需元素)、有害元素(As、Cd、Hg等)。
3.绝大多数的含碳化合物属于有机物(如CH4、C2H5OH、CH3COOH等)。塑料、合成纤维、合成橡胶称为三大合成材料。塑料垃圾造成的污染称为白色污染。
考点17:实验基本操作
(1)药品的取用
①固体:块状“一平、二放、三慢立”;粉末状“一平、二送、三直立”
②液体:量少用滴、量多用倒(定量用量筒)“瓶塞倒放桌、标签向手心、口口紧相挨、试管略倾斜”
(2)物质的加热
①可加热仪器一一试管、蒸发皿、燃烧匙(前三者可直接在火焰上加热)、烧杯(瓶)(垫上石棉网间接加热)
②酒精灯的使用:严禁互点、不可吹灭与燃着添加
③用试管夹夹住、要用外焰加热、先匀热后集中、固体管口略向下、液体管口斜向上、液体不超三分一、管口不对着人。
(3)检查气密性
导管一端入水、手掌紧贴瓶壁、管口冒泡、手离器壁水升、便知气密良好
(4)计量
①用天平称质量;精确到O.1g、左物右码、加码先大后小、腐蚀性药品间接称量
②用量筒量体积:选择适当量程、读数三点一线,不可简中稀释与反应
(5)物质的存放:广口瓶装固体、细口瓶装液体、集气瓶装气体
(6)胶头滴管的使用:悬空滴加、停加正放、严禁一管多用。(其中滴瓶上的滴管只能专用)
(7)过滤:是分离固液混合物的方法。要注意“一贴、二低、三靠”。
(8)蒸发:是除去溶剂获得更浓溶液或晶体的方法。蒸发过程要用玻璃棒不断搅拌以加快溶剂蒸发和防止液滴飞溅出来。
(9)蒸馏:分离两种或两种以上沸点不同的液体的方法。注意水流方向与气流方向相反。
中考必须记住的化学用语
一、元素的名称及符号
原子序数 | l | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | lO | ll | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
元素名称 | 氢 | 氦 | 锂 | 铍 | 硼 | 碳 | 氮 | 氧 | 氟 | 氖 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
元素符号 | H | He | Li | Be | B | C | N | O | F | Ne | Na | Mg | Al | Si | P | S | Cl | Ar |
元素名称 | 钾 | 钙 | 锰 | 铁 | 锌 | 银 | 钡 | 碘 | 汞 | 铜 | 锡 | 铅 | 铂 | 金 |
元素符号 | K | Ca | Mn | Fe | Zn | Ag | Ba | I | Hg | Cu | Sn | Pb | Pt | Au |
二、离子符号
名称 | 符号 | 名称 | 符号 | 名 称 | 符号 | 名 称 | 符号 |
钠离子 | Na+ | 钾离子 | K+ | 氯离子 | Cl- | 高锰酸根离子 | Mn04- |
钙离子 | Ca2+ | 亚铁离子 | Fe2+ | 氧离子 | 02- | 锰酸根离子 | Mn042- |
氢离子 | H+ | 铁离子 | Fe3+ | 硫离子 | S2- | 硫酸根离子 | SO42- |
铜离子 | Cu2+ | 铵根离子 | NH4+ | 氢氧根离子 | OH- | 碳酸根离子 | C032- |
镁离子 | Mg2+ | 锌离子 | Zn2+ | 硝酸根离子 | N03- | 碳酸氢根离子 | HCO3- |
铝离子 | Al3+ | 银离子 | Ag+ |
三、化学式
四、化学方程式
有关反应 | 化学方程式 | 备注 |
碳充分燃烧 | C + O2 CO2 | 氧气的性质 |
碳不充分燃烧 | 2C + O2 2CO | |
氧气与硫反应 | S + O2 SO2 | |
氧气与磷反应 | 4P + 5O2 2P2O5 | |
氧气与铁反应 | 3Fe + 2O2 Fe3O4 | |
氧气与铝反应 | 4Al + 3O2 2Al2O3 | |
氧气与镁反应 | 2Mg + O2 2MgO | |
用高锰酸钾制取氧气 | 2KMnO4 K2MnO4 + MnO2 + O2↑ | 氧气的实验室制法 |
用过氧化氢制氧气 | 2H2O2 2H2O+ O2 ↑ | |
氧化汞加热分解 | 2HgO 2Hg+02↑ | |
电解水 | 2H2O 2H2↑+ O2 ↑ | |
氢气的燃烧 | 2H2+02 2H20 | |
二氧化碳通入澄清石灰水 | C02+Ca(OH)2=CaC03↓+H20 | 二氯化碳的性质 |
碳酸钠与盐酸反应 | Na2C03+2HCl=2NaCl+C02↑+H20 | |
氢气还原氧化铜 | H2+CuO Cu+H20 | 氢气的还原性 |
铁与硫酸铜溶液反应 | Fe+CuS04==FeSO4+Cu | |
锌与稀硫酸反应制取氢气 | Zn+H2S04==ZnS04+H2↑ | 氢气实验室制法 |
碳还原氧化铜 | C+2CuO 2Cu+C02↑ | 碳的还原性 |
碳与二氧化碳反应 | C + CO2 2CO | |
氢氧化钠与硫酸铜反应 | 2NaOH+CuS04=Cu(OH)2↓+Na2S04 | 盐的化学性质 |
氢氧化钠与氯化铁反应 | 3NaOH+FeCl3=Fe(OH)3↓+3NaCl | |
氯化钡与硫酸钠反应 | BaCl2+Na2S04=BasS04 ↓+2NaCl | |
氯化钠与硝酸银反应 | NaCl+AgN03=AgCl↓+NaN03 | |
氧化钙与水反应 | CaO+H20==Ca(OH)2 |
附:酸、碱、盐、氯化物的性质
1.酸和碱的化学性质:
性质 | 酸(五条) | 碱(四条) | 备注 |
与指示剂的作用 | 酚酞:无色 石蕊:红色 | 酚酞:红色石蕊:蓝色 | |
与活泼金属反应 | Zn+H2S04=ZnS04+H2↑ | 一般无此性质 | |
与氧化物的反应 | 3H2S04+Fe203=Fe2(S04) +3H20 | 2NaOH+C02=Na2C03+H20 | |
中和反应 | H2S04+2NaOH=Na2S04+2H2O | 酸碱共性 | |
与盐的反应 | H2SO4+Na2C03=Na2SO4 + C02↑+H2O | 2NaOH+CuS04=Cu(OH)2↓+Na2S04 | 盐的化性 |
2.盐的化学性质(四条):
(1)盐+金属=新盐+新金属
例如:Fe+CuS04=FeSO4+Cu
(2)盐+碱=新盐+新碱
例如:Na2CO3+Ba(OH)2=2NaOH+BaC03↓
(3)盐+酸=新盐+新酸
例如:CaC03+2HCI=CaCl2+H20+C02↑ BaCl2+H2S04=BaS04↓+2HCl
(4)盐l+盐2=新盐l+新盐2
例如:BaCl2+Na2SO4=BaS04↓+2NaCI
3.氧化物的化学性质:

 加载中,请稍侯......
加载中,请稍侯......
精彩评论