在空气的组成成分中,与我们人类关系最密切的当属氧气,因为它是维持人类生命不可缺少的气体,所以人们曾把它叫做“养 气”。
氧气的物理性质在通常状况下是一种没有颜色、没有气味的气体。在标准状况下,氧气的密度是1.429g/L,比空气略大(空气的密度是1.293g/L)。它不易溶于水,1L升水中只能溶解约30mL氧气。在压强为101kPa时,氧气在约-183℃(90K)时变为淡蓝色液体,在约-218℃(55K)时变成雪花状的淡蓝色固体。
氧气的化学性质比较活泼,跟很多物质都能发生化学反应,同时放出热量。物质在氧气中燃烧的现象:木炭在氧气中燃烧更旺,发出白光,放出大量的热;铁丝在氧气中剧烈燃烧,火星四射,刚出大量的热,生成黑色固体。蜡烛在氧气中燃烧更旺,发出白光,放出热量。
氧气的检验:将带火星的木条伸入待测气体中,若木条复燃,则该气体是氧气。
实验室制取氧气
1、分解过氧化氢
(1)药品:过氧化氢溶液(无色液体)、二氧化锰固体(黑色固体)。
(2)反应原理:
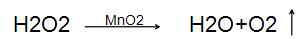
(3)发生装置的选择:由于过氧化氢是液体,二氧化锰是固体,且反应不需要加热采用锥形瓶、广口瓶或试管作为反应容器,配双孔胶塞(一孔插入分液漏斗或长颈漏斗,另一孔插人导管)。
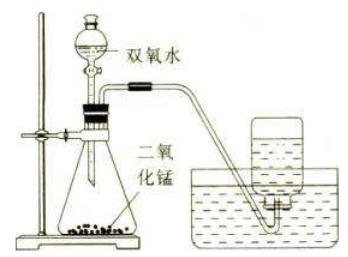
(4)收集装置的选择:由于氧气不易溶于水且不与水反应,故要收集较纯净的气体采用排水法。又由于氧气的密度比空气的密度大,故要收集较干燥的氧气时,需采用向上排空气法。
(5)实验装置:
(6)实验步骤
①检查装置的气密性。方法:先在分液漏斗中注入水,将导气管的末端放入水中,双手捂住锥形瓶(若在夏天可用热毛巾捂住或用热水浴),看导管口是否有气泡冒出,如果有气泡冒出,且放手后导管中有一段水柱上升,说明装置气密性良好②向锥形瓶中加入二氧化锰固体。③塞好带有分液漏斗(或长颈漏斗)和导管的双孔塞。④向分液漏斗(或长颈漏斗)中加入过氧化氢溶液⑤用排水集气法收集气体。
二氧化锰是这个反应的催化剂,加快反应进行,它的化学性质与质量在整个反应中都不会发生变化。
中考真题
1、下列描述属于氧气化学性质的是 (C)
A.通常状况下,氧气是无色、无味的气体B.通过低温加压,可使氧气液化成淡蓝色的液体C.液态氧可用作发射火箭的助燃剂D.氧气是一种性质比较活泼的气体,能氧化许多物质
2、下列反应不属于缓慢氧化的是(A)
A.镁条燃烧 B.铁质菜刀生锈 C.人的呼吸过程 D.农家肥料的腐熟过程
3、同学们围绕“铁在氧气里燃烧”的实验展开以下探究活动。
活动一:探究铁丝在氧气中燃烧时“火星四射”的现象与其含碳量的关系
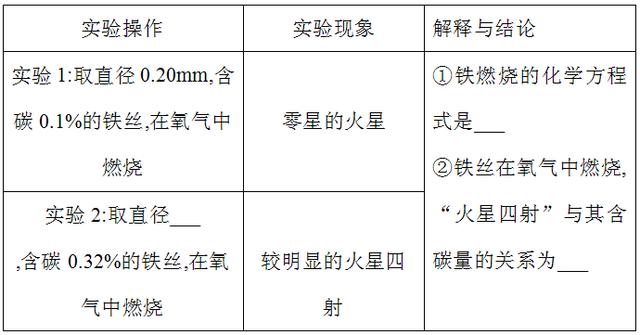
活动二:探究铁燃烧时溅落下来的黑色物质中是否有铁单质同学们认为铁丝燃烧的现象还与氧气的浓度有关,所以想收集不同浓度的氧气进行相关实验,若用排水法收集一瓶体积分数为90%的氧气,预先应向容积为400mL的集气瓶中加水,水的体积约为___mL.
①自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);
②铁的氧化物均能溶于酸。

分析:已知:高温条件下铁和水能反应生成四氧化三铁和氢气,则该反应的化学方程式为___.由此可知探究活动二中为了防止集气瓶炸裂,应采取的措施是___.
根据已有的铁丝燃烧的现象结合铁的性质进行分析解答,铁能与氧气反应生成四氧化三铁,铁能与盐酸反应生成氢气,根据反应物和生成物书写反应的化学方程式,据此解答.
解答:
活动一:设计实验要注意控制变量,保证铁丝的直径相同;铁在氧气中燃烧生成四氧化三铁,根据表格提供的数字可以看出,铁丝中的含碳量越高,火星越明显,故填:0.20,3Fe+2O2= Fe3O4,含碳量越高,火星越明显;用排水法收集一瓶体积分数为90%的氧气,预先应向容积为400mL的集气瓶中加水,则气体的总体积为400mL,其中氧气的体积为:400mL×90%=360mL,设水的体积为x,则有(400mL-x)×1/5+x=360mL,x=350mL,故填:350;
活动二:铁能与盐酸反应生成氢气,故要证明含有铁,可以加入稀盐酸,观察到有气泡产生,证明含有铁,故填:

高温条件下铁和水能反应生成四氧化三铁和氢气,该反应的化学方程式为 3Fe+4H2O高温 Fe3O4+4H2.为了防止集气瓶炸裂,应采取的措施是在集气瓶底部铺一层细沙.故填:3Fe+4H2O高温 Fe3O4+4H2,在集气瓶底部铺一层细沙.
 加载中,请稍侯......
加载中,请稍侯......
精彩评论