绝密★ 启用前
2018年普通高等学校招生全国统一考试
理科综合能力测试
注意事项:
1、答题前,考生务必将自己的姓名、准考证号填写在答题卡上。
2、回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3、考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Al-27 P-31 Cu-64
7.化学与生活、社会发展息息相关,下列有关说法不正确的是( )
A.玛瑙的主要成分是二氧化硅,陶瓷的主要成分是硅酸盐
B.医院常用乙醇、次氯酸钠溶液、双氧水消毒,其消毒原理不相同
C.工业用盐亚硝酸钠有咸味,可被用来制造食盐
D.东汉魏伯阳在《周易参同契》中对汞的描述:“……得火则飞,不见埃尘,将欲制之,黄芽为根。”这里的“黄芽”是指硫
【答案】C
8.设NA为阿伏加德罗常数的值,下列说法中正确的是 ( )
A.1.8g H218O与D2O的混合物中含有的质子数和电子数均为NA
B.精炼铜,若阳极失去0.1NA个电子,则阴极增重3.2g
C.将1L 0.5mol/L的FeCl3溶液加入到沸水中,加热使之完全反应,所得氢氧化铁胶体粒子数为0.5NA
D.标准状况下,22.4L CHCl3所含有的分子数目小于NA
【答案】B
9.下列关于有机物的说法正确的是( )
A.纤维素、橡胶和光导纤维都属于有机高分子化合物
B.除去乙烷中的乙烯时,通入氢气并加催化剂加热
C.CH3COOCH2CH3与 H218O发生水解反应,生成的产物中有CH3CH218OH
D.含苯环结构且分子式为C6H5Cl的有机物中一个氢被—C5H11原子团取代形成的有机物共有24种
【答案】D
10.下列实验操作、现象与结论对应关系正确的是 ( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向装有某未知溶液的试管中滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀生成 | 说明该未知溶液中可能含SO42- |
B | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4 | 管口观察到红棕色气体 | HNO3分解成了NO2 |
C | 将溴水加入苯中 | 溴水颜色变浅 | 苯与溴水发生取代反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
【答案】A
11.利用在特定条件下用铂电极(阳极为铂丝)电解饱和硫酸氢钾溶液的方法制备K2S2O8(过二硫酸钾)。在低温下电解液中主要含有K+、H+和HSO4-离子,电流通过溶液后,发生电极反应,在阳极区可得K2S2O8。下列说法中不正确的是( )
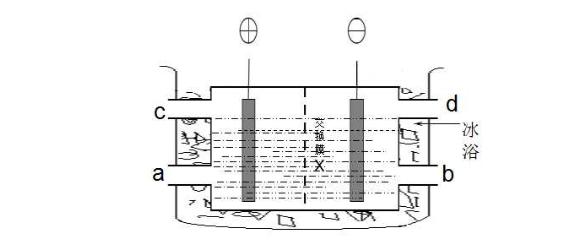
A.X是质子交换膜 B.d出口有O2放出
C.阳极反应:2HSO4--2e-=S2O82-+2H+D.低温饱和硫酸氢钾溶液在a口加入
【答案】B
12.短周期元素X、Y、Z、W、R的原子序数依次增大。X的单质是最轻的气体,且是一种清洁能源,Y原子最外层电子数是内层电子数的3倍,Z是短周期主族元素中原子半径最大的,W的最外层电子数与R的电子数之和等于Y与Z的电子数之和,R的最高正价和最低负价的代数和为4,下列推断正确的是( )
A.原子半径:Z>R>W>Y>X
B.X与Y形成的化合物的沸点比X与R形成的化合物的沸点低
C.Z、W、R的最高价氧化物对应的水化物能两两反应
D.可以通过电解W的氯化物来制取W单质
【答案】C
13.25℃时,将浓度均为0.1mol/L 、体积分别为Va和Vb的HX溶液与NH3·H2O溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法不正确的是( )
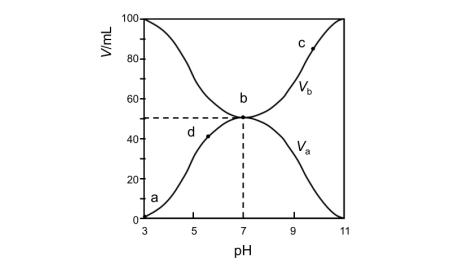
A.b点,c(NH4+)+c(HX)=0.05mol/L B.c、d两点,
值相等
C.Ka(HX)的值与Kb(NH3·H2O)的值相等 D.a→d点过程中,存在c(X-)=c(NH4+)
【答案】D
26.(14分)磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2在活性炭作用下反应制取少量的SO2Cl2,装置如下图所示(有些夹持装置省略)。已知SO2Cl2的熔点为-54.1 ℃,沸点为69.1 ℃,遇水能发生剧烈的水解反应,并产生白雾。
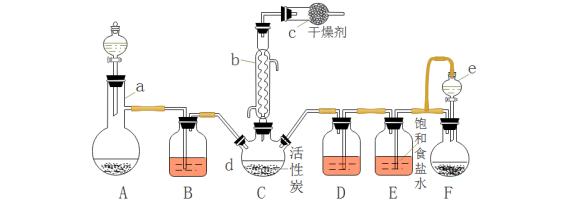
(1)仪器a的名称:____________,仪器e中的导管的作用是:_______________________。
(2)C中发生的反应方程式是:___________________________________,仪器c的作用是:
___________________________________________________________________________。
(3)A装置是实验室制无色气体甲,其离子方程式:________________________________。
(4)B中装的试剂是:________________。
(5)反应结束后,将C中产物分离的实验操作是____________。
(6)分离产物后,向获得的SO2Cl2中加入足量NaOH溶液,振荡、静止得到无色溶液乙。
①写出该反应的离子方程式:_____________________________________;
②检验溶液乙中存在Cl-的方法是:_________________________________________________。
【答案】(1)蒸馏烧瓶 (1分) 平衡气压,使漏斗内的液体顺利流下 (1分)
(2)SO2 + Cl2=== SO2Cl2 (2分) 吸收尾气Cl2、SO2,防止环境污染,同时防止空气中的水蒸气进入C装置引起磺酰氯水解 (2分)
(3)2H+ + SO32-=== H2O + SO2↑ (1分)
(4)浓H2SO4 (1分)
(5)蒸馏 (1分)
(6)① SO2Cl2+4OH-===2Cl-+SO42-+2H2O (2分)
② 取少量乙于试管中,加入足量Ba(NO3)2溶液,静置,取上层清液加入硝酸酸化的AgNO3溶液,有白色沉淀生成,则乙中存在Cl-(3分)
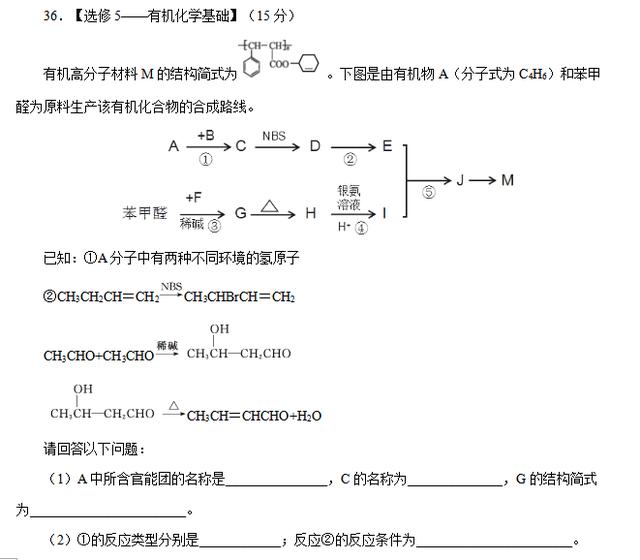
27.(14分)钛酸钡是一种强介电化合物材料,是电子陶瓷中使用最广泛的材料之一。工业制取方法如下,先获得不溶性草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧后可获得钛酸钡粉体。
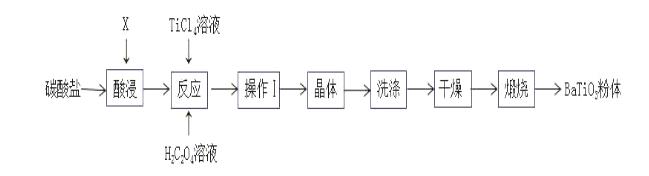
(1)该过程中使用的碳酸盐是:___________,“酸浸”选用的酸:__________,酸浸时发生的反应的离子方程式为:_________________________________________。
(2)工业上一种制四氯化钛的方式是将TiO2和黑色非金属单质粉末混合加热至1000~1100K,进行氯化处理,生成TiCl4。该过程发生的化学方程式:__________________________。
(3)加入H2C2O4溶液后,进行的操作Ⅰ是:__________。
(4)煅烧时发生的化学反应方程式:_______________________________________________。
(5)“钡餐”是进行胃部透视时的造影剂,其是一种难溶性的钡盐——硫酸钡(Ksp(BaSO4)=1.05×10-10)。当人体中Ba2+浓度达到2.3×10-3mol/L时,就会中毒对健康产生严重危害。如果病人误服了碳酸钡,也会中毒。误服碳酸钡引起中毒的原因:____________________。能否通过立即服用密度为1.05g/mL质量分数为7.1%硫酸钠溶液解毒,为什么?(如果能,通过计算说明)
_______________________________________________________________________________
______________________________________________________________________________。
【答案】(1)BaCO3 (1分) HCl (1分) BaCO3+2H+ = Ba2+ + CO2↑+H2O (1分)
(2)TiO2+2C+2Cl2===TiCl4+2CO (3分)
(3)过滤 (1分)
(4)BaTiO(C2O4)2·4H2O = BaTiO3 + 2CO↑ + 2CO2↑ + 4H2O (3分)
(5)胃液的酸性较强能与 BaCO3反应产生Ba2+使人中毒 (1分) 能,服用硫酸钠溶液后,Ba2+与SO42-结合生成难溶物BaSO4。根据硫酸钡的Ksp和硫酸钠的浓度,能求出
(mol/L)<<2.3×10-3mol/L
能达到解毒的效果。(3分)
28.(15分)一氧化碳和氢气是重要的化工原料,可以用于合成甲醇、二甲醚、甲酸甲酯等。
Ⅰ.(1)已知CO(g)、CH3OH(l)、CH3COOH(l)的燃烧热分别是△H(CO)=﹣283.2 kJ/mol、△H(CH3OH)=﹣723.6 kJ/mol和△H(CH3COOH)=﹣870.3 kJ/mol,则通常状况下甲醇与一氧化碳催化合成乙酸的热化学方程式是:_______________________________________________。
Ⅱ.(2)有人设想将CO按下列反应除去:2CO(g)
2C(s)+O2(g) ΔH>0,请你分析该设想能否实现?_______(填“是”或“否”),依据是______________________________________。
(3)在体积可变的密闭容器中投入2 mol CO和2 mol H2,在不同条件下发生反应:CO(g)+2H2(g)
CH3OH(g) ΔH。实验测得平衡时CO的平衡转化率随温度、压强的变化如图所示。
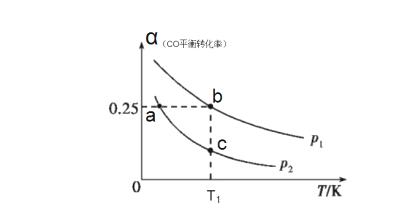
①该可逆反应的ΔH_____0(填“>”“<”或“=”)。a、b、c三点对应的平衡常数Ka、Kb、Kc的大小关系是________________。
②若在恒温恒容条件下进行上述反应,能表示该可逆反应达到平衡状态的是_____(填字母)。
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内消耗CO的浓度等于生成CH3OH的浓度
③若该可逆反应是在T1温度下进行,达到平衡时容器体积 2L,则T1温度条件下的平衡常数K=_________(保留三位小数)
Ⅲ.(4)一定条件下,CO可与粉末状氢氧化钠作用生成甲酸钠。已知常温时,甲酸的电离平衡常数Ka=1.70×10-4。
向20 mL 0.1 mol/L的甲酸钠溶液中滴加10 mL 0.1 mol/L 的盐酸,混合液呈____性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为__________________________________。
【答案】(1)CO(g)+CH3OH(l)=CH3COOH(l) △H=﹣136.5kJ/mol (2分)
(2)否(1分) 该反应是焓增、熵减的反应,ΔG=ΔH﹣TΔS>0,反应不能自发进行(2分)
(3)① < (1分) Ka﹥Kb=Kc (1分)② AC (2分) ③ 1.33 (2分)
(4)酸(2分) c(Na+)>c(HCOO-)>c(Cl-)>c(H+)>c(OH-) (2分)

 加载中,请稍侯......
加载中,请稍侯......
精彩评论